La presencia de somnolencia en pacientes con síndrome de apneas-hipopneas durante el sueño (SAHS) resulta en la actualidad comprensible. Más difícil de explicar es que la mayoría de los pacientes con SAHS incluidos en estudios epidemiológicos, incluso aquellos con un alto índice de apneas-hipopneas, no presente excesiva somnolencia diurna. Los motivos van más allá de los simples eventos polisomnográficos.
En este artículo se repasarán los datos de la literatura médica que pueden ayudar a comprender la falta de excesiva somnolencia diurna en estos pacientes. Además, se analizarán los estudios que defienden y niegan que la somnolencia en pacientes con SAHS sea un marcador de riesgo cardiovascular y los mecanismos por los que pudiera aumentar este riesgo.
Nowadays, sleepiness in patients with sleep apnea-hypopnea syndrome (SAHS) is understandable. It is somewhat more difficult to explain why most patients with SAHS enrolled in epidemiologic studies, even those with a high apnea-hypopnea index, do not experience excessive daytime sleepiness. The reasons for this discrepancy lie beyond mere polysomnographic events.
This review examines data from the literature that may help us understand why these patients do not experience daytime sleepiness. It also analyzes studies that support and refute sleepiness as a marker of cardiovascular risk in patients with SAHS, and discusses the mechanisms that might increase this risk.
Al contrario de lo que en principio puede parecer, la mayoría de los pacientes con síndrome de apneas-hipopneas durante el sueño (SAHS) no presenta excesiva somnolencia diurna (ESD) y, además, la prevalencia de somnolencia no es muy superior en estos pacientes respecto a la población general. Según una reciente revisión de los datos del Sleep Heart Health Study, la ESD, establecida en una puntuación superior a 10 en la escala de somnolencia Epworth, se presentaba hasta en un 21% de las personas sin apneas del sueño, mientras que entre los pacientes con un índice de apneas-hipopneas (IAH) mayor de 30 sólo el 40% de los casos presentaba somnolencia1. Del mismo modo, en un estudio realizado en nuestro país2 sólo el 21% de los varones y el 26% de las mujeres con un IAH superior a 5 referían ESD, frente al 12% de los varones y el 28% de las mujeres con un IAH inferior a 5.
Motivos de la ausencia de excesiva somnolencia diurna en pacientes con síndrome de apneas-hipopneas durante el sueñoNo es sorprendente que los afectados de SAHS presenten somnolencia. De hecho, cuando King et al3 indujeron SAHS a sujetos sanos administrándoles una presión nasal de –10 cmH2O, encontraron que la latencia de sueño durante el día siguiente disminuía. Además, tras una segunda noche de control en que se retiró la presión subatmosférica, los sujetos volvían a los valores de latencia de sueño basales. Esto indica que las apneas de forma aguda producen somnolencia. Más difícil de explicar es el hecho de que muchos de los pacientes con SAHS no presenten somnolencia diurna; a continuación se exponen las teorías que pueden explicar este hecho.
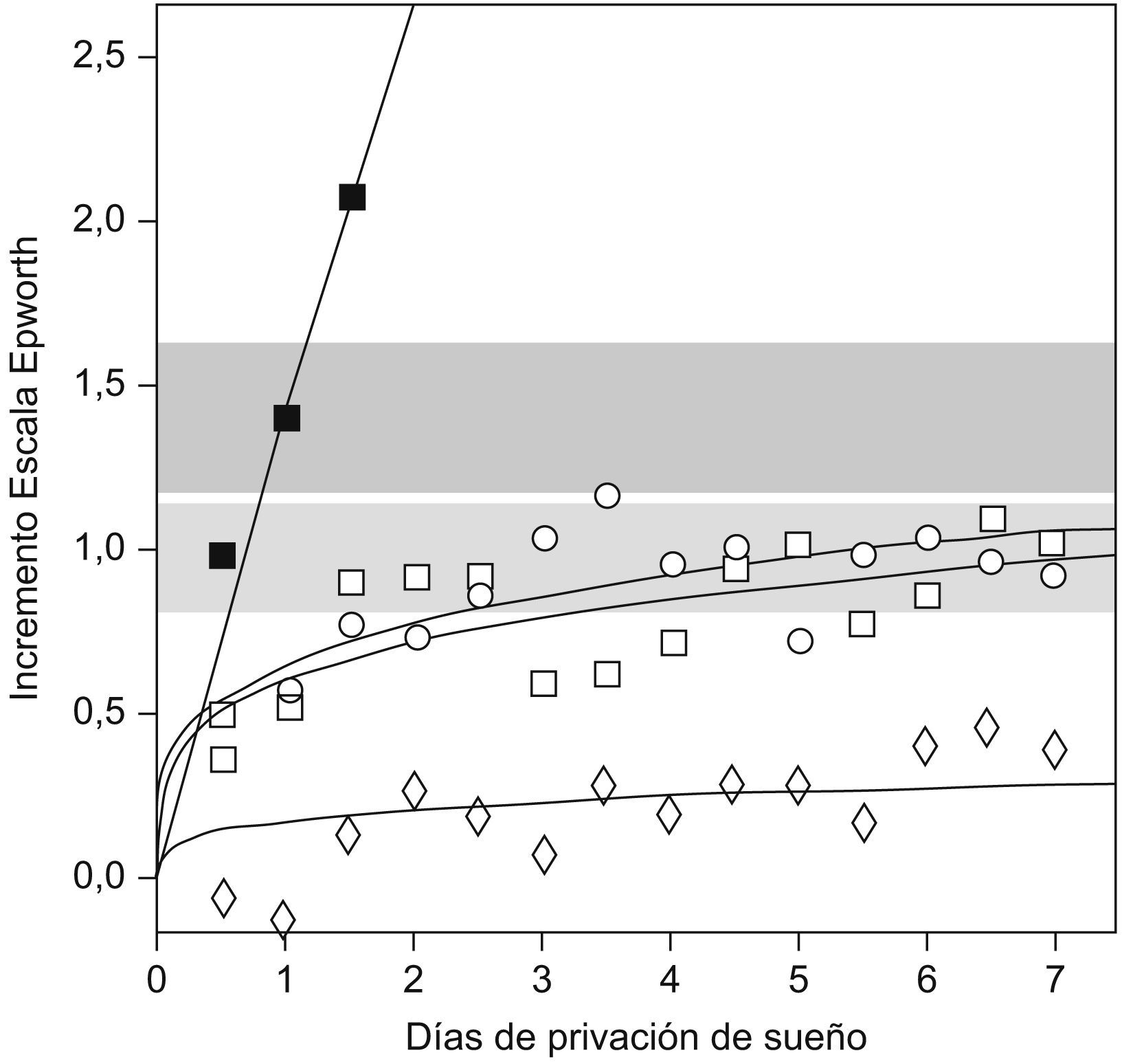
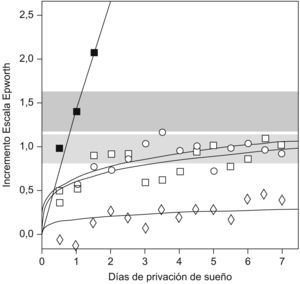
Mecanismo de adaptación temporalEn primer lugar, es posible que los pacientes con SAHS que no presentan somnolencia tengan una adaptación en el tiempo a una enfermedad crónica. Van Dongen et al4 compararon la somnolencia producida por una restricción total de sueño durante 3 días frente a la producida por una restricción parcial (4; 6, u 8h/día) durante 14 días en un grupo de personas sanas. Se observó que la privación total de sueño tiene una respuesta aguda con un incremento progresivo de la somnolencia durante los 3 días. En cambio, la privación crónica tiene un efecto agudo al principio, pero no hay mayor incremento después del segundo o tercer días, lo que apuntaría a la existencia de un mecanismo de adaptación (fig. 1).
Incremento de la somnolencia en la escala de Epworth en un grupo de sujetos sanos tras la privación aguda y crónica de sueño. (Modificada de Van Dongen et al4).
Otro estudio que pone en la pista de un mecanismo de adaptación temporal a la ESD es el de Bjorvatn, que estudió a un grupo de 17 sujetos que referían problemas de adaptación a un trabajo por turnos. Se les midió la somnolencia durante 14 días consecutivos en los que trabajaron en turno nocturno la primera semana, para pasar la segunda semana a turno diurno. Se encontró que la somnolencia subjetiva era alta al principio de la semana en que trabajaban en horario nocturno, para luego disminuir a lo largo de la semana; al cambiar al turno diurno, volvía a aumentar la somnolencia y, a medida que avanzaba la semana, otra vez volvía a disminuir5.
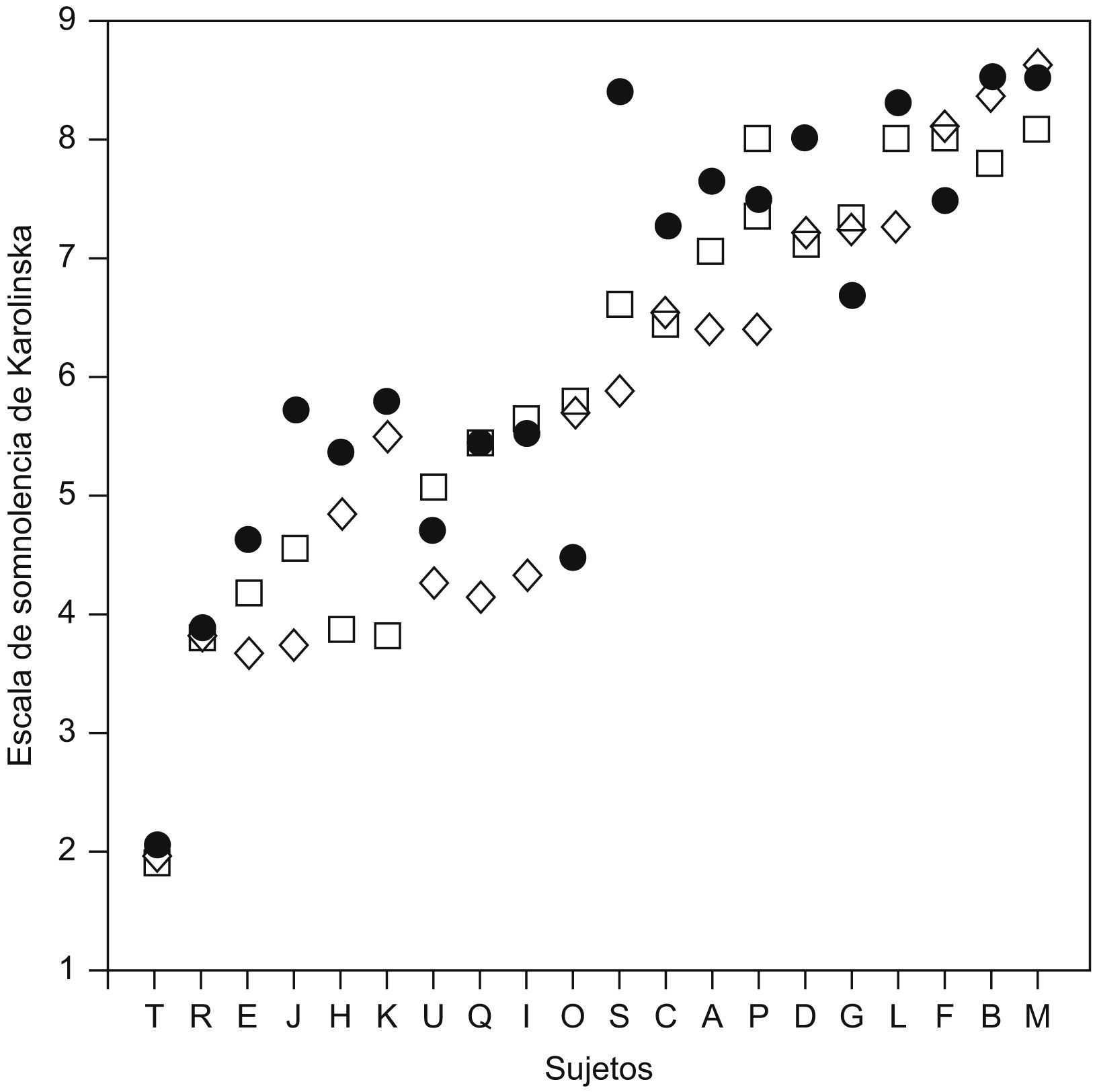
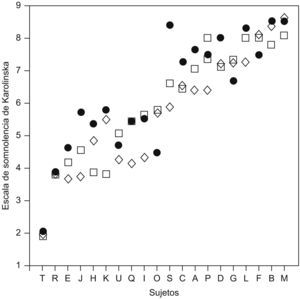
Vulnerabilidad frente a resistencia a la somnolenciaVan Dongen6 sometió a un grupo de 21 sujetos sanos a 36h de restricción total de sueño y cada 2h se les media la somnolencia subjetiva. Este experimento se realizó en 3 ocasiones en cada sujeto. La somnolencia, medida con la escala de Karolinska, fue diferente entre los distintos sujetos, y esta diferencia permaneció estable en los 3 experimentos. Es decir, había personas vulnerables y otras resistentes a la restricción total de sueño. En la figura 2 se ven los sujetos del experimento representados por distintas letras y las 3 medidas de la escala de Karolinska.
Escala de somnolencia de Karolinska en sujetos sanos, tras 36h de privación total de sueño, en 3 ocasiones distintas. Cada sujeto se nombra mediante una letra. (Modificada de Van Dongen6).
Más adelante se detallarán las evidencias que existen sobre la hipoxia como causa de somnolencia, pero ahora analizaremos el trabajo de Sanfilippo-Cohn et al7 como justificación de la teoría de la vulnerabilidad individual a la somnolencia. Estos autores indujeron hipoxia intermitente o normoxia de forma aleatorizada a un grupo de ratones machos y hembras. En los ratones machos la hipoxia intermitente producía una disminución de la latencia de sueño y mayor tiempo de sueños REM, no REM y total. En cambio, las hembras eran resistentes al efecto de la hipoxia intermitente sobre la somnolencia objetiva y sobre el tiempo de sueño.
Actividad simpática/parasimpáticaA finales de los ochenta ya se comprobó que en pacientes con SAHS el aumento de la somnolencia diurna se correlaciona con la actividad del sistema nervioso autónomo. Así, Pressman y Fry8 estudiaron a un grupo de personas con SAHS y determinaron el grado de actividad simpática/parasimpática mediante el reflejo pupilar a la luz. Encontraron que el aumento de la latencia de sueño en el test de latencia múltiple se correlacionaba con un mayor grado de actividad parasimpática y que la somnolencia subjetiva se correlacionaba indirectamente con el grado de actividad simpática.
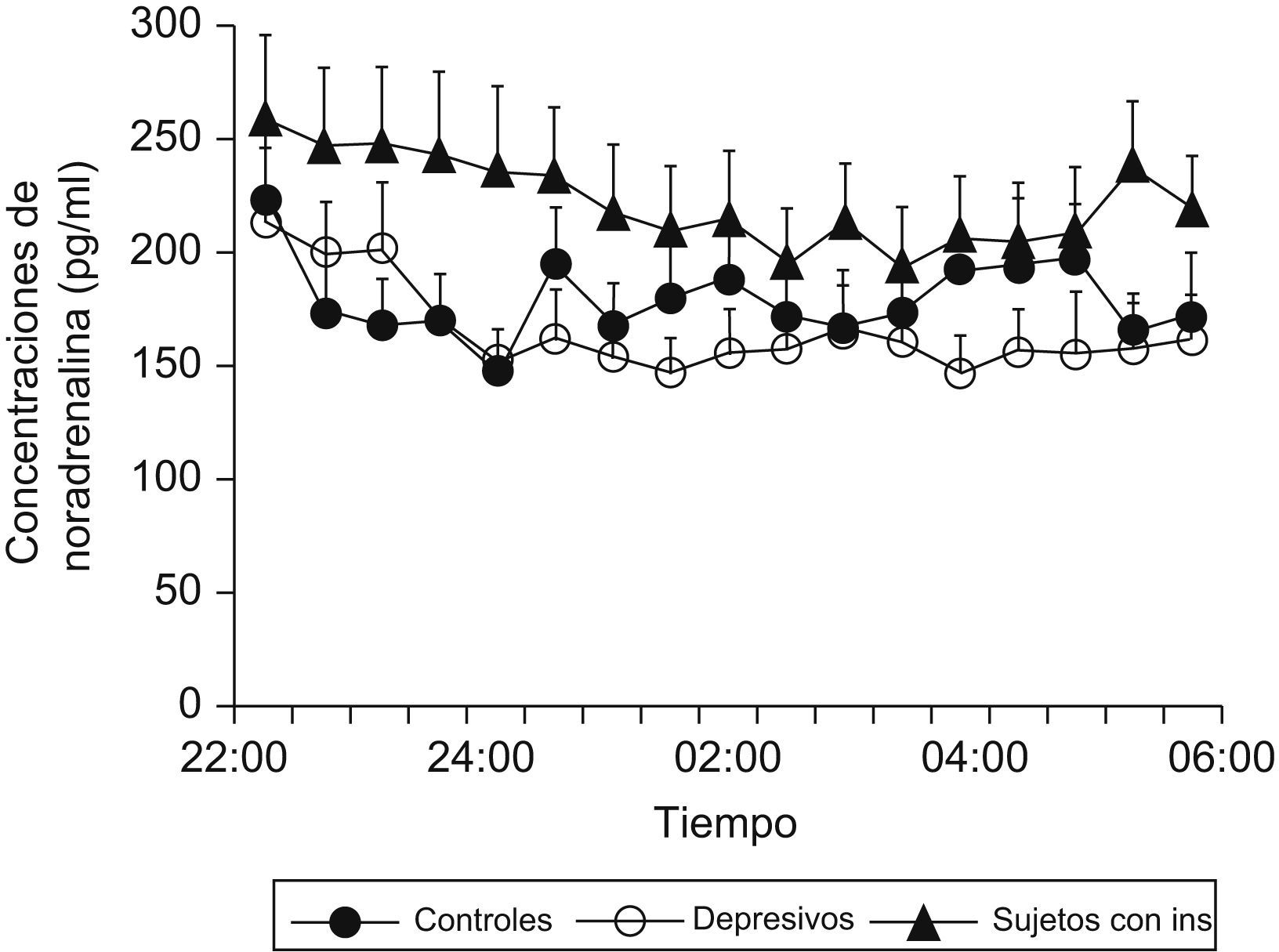
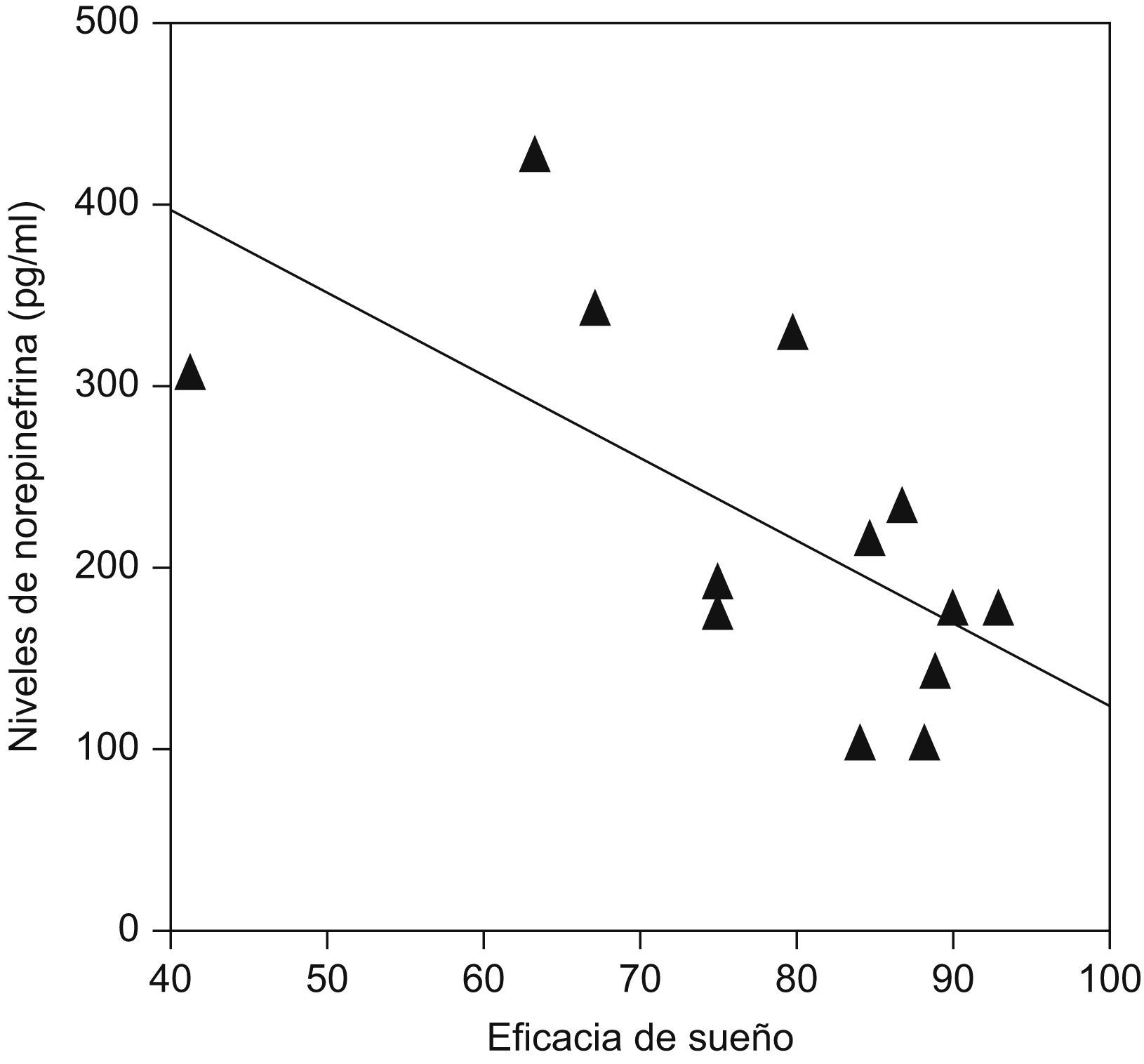
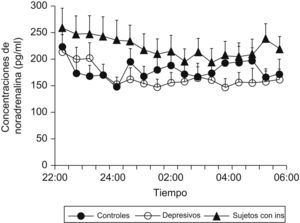
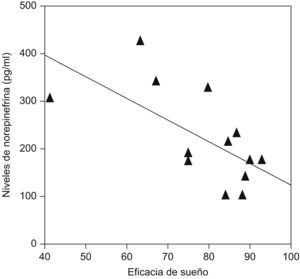
Se ha demostrado que pacientes que presentan insomnio tienen un aumento de la actividad simpática (noradrenalina) circulante durante el sueño comparados con sujetos controles (fig. 3), y que existe una correlación negativa entre las concentraciones de noradrenalina y la eficiencia de sueño en este tipo de pacientes (fig. 4)9.
Concentraciones nocturnas de noradrenalina circulante en sujetos con insomnio, pacientes depresivos y controles. (Modificada de Irwin M et al9).
Correlación inversa entre las concentraciones sanguíneas de noradrenalina y la calidad de sueño (eficiencia) en pacientes con insomnio. (Modificada de Irwin M et al9).
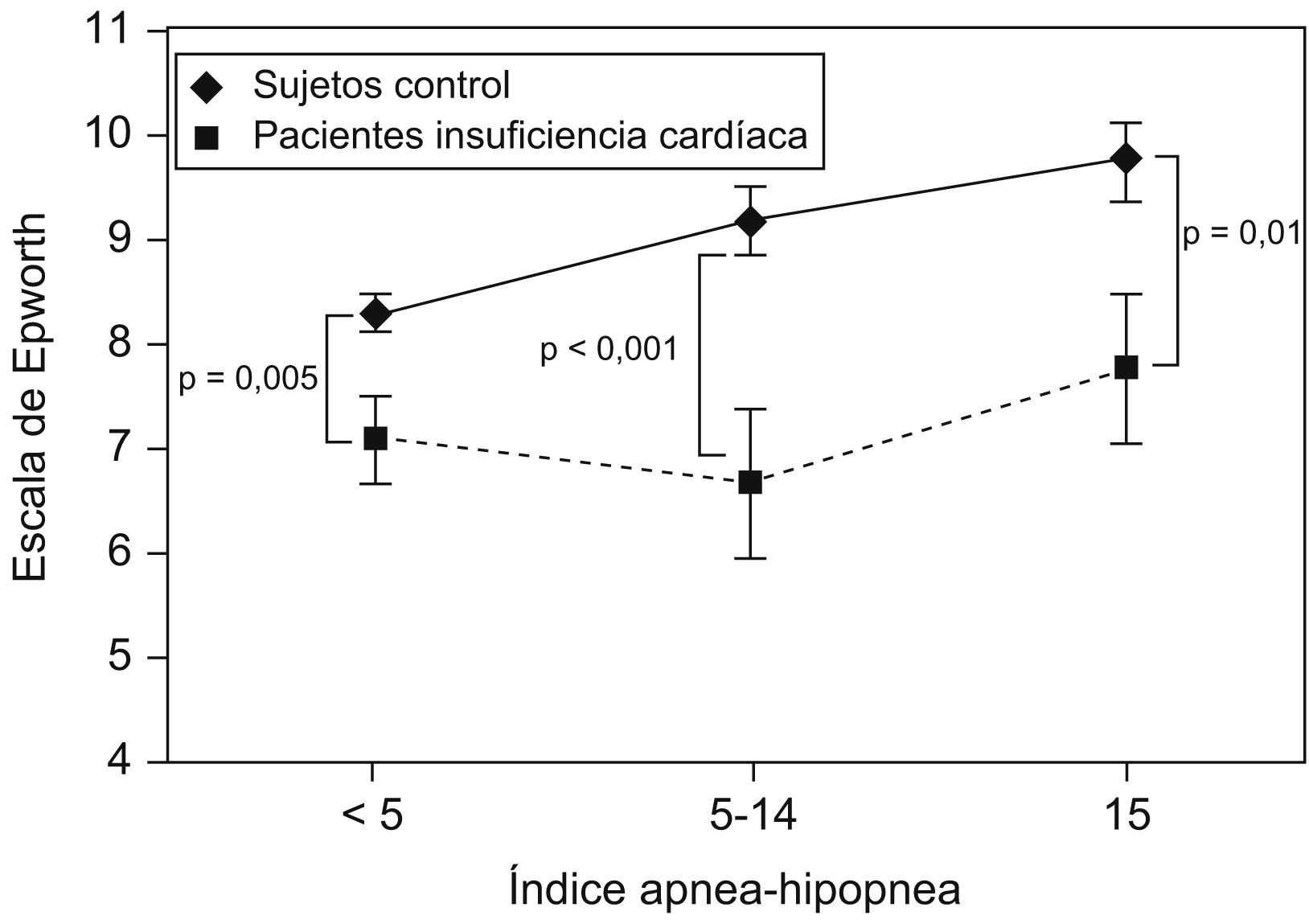
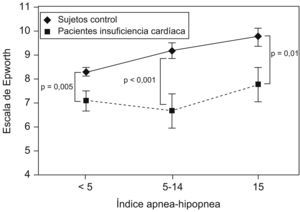
Arzt et al10 estudiaron a un grupo de 155 pacientes con insuficiencia cardíaca a los que se realizó una polisomnografía y que se compararon con un grupo control de más de 1.000 pacientes pertenecientes a la cohorte de Wisconsin. Se encontró que, para un mismo IAH, los pacientes con insuficiencia cardíaca tenían menos somnolencia subjetiva a pesar de dormir menos (tiempo total de sueño en la polisomnografía) (fig. 5). Estos autores señalan que el motivo debe de ser el incremento del tono simpático que presentan los pacientes con insuficiencia cardíaca.
Escala de somnolencia de Epworth en pacientes con y sin insuficiencia cardíaca, para un mismo índice de apneas-hipopneas. (Modificada de Arzt M et al10).
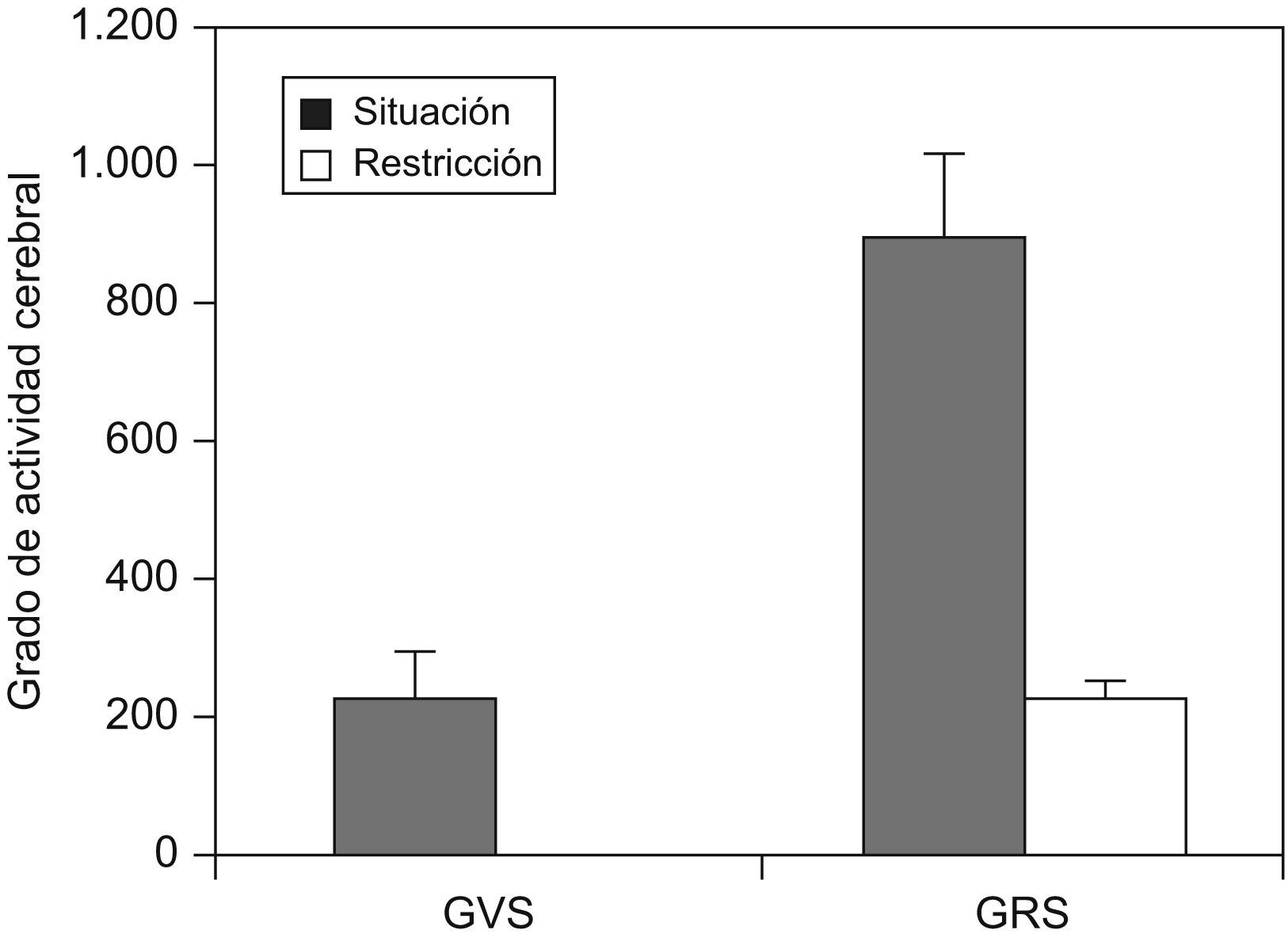
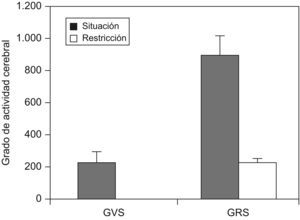
Mu et al11 realizaron un estudio en 33 sujetos sanos en condiciones basales y después de 30h de privación de sueño. Se les efectuó una resonancia magnética mientras realizaban el test de memoria de Sternberg. Se observó que, entre los 33 sujetos estudiados, había un grupo de 10 que eran resistentes a la privación de sueño (medido mediante un test de memoria) y en ellos la activación cerebral (medida mediante resonancia magnética) era mayor que en los vulnerables a la restricción de sueño (fig. 6).
Actividad cerebral, medida mediante resonancia magnética, en pacientes vulnerables y resistentes a la privación de sueño. GRS: grupo resistente a la privación de sueño; GVS: grupo vulnerable a la privación de sueño. (Modificada de Mu Q et al11).
Los pacientes con SAHS sin somnolencia pueden tener un umbral de microdespertar disminuido. En un estudio reciente12 se ha observado que, para un mismo IAH, los pacientes con SAHS y somnolencia eran los que presentaban apneas de mayor duración y menor saturación mínima y media durante la noche. Los autores apuntan que esto puede deberse a un incremento del umbral de microdespertar en los pacientes con ESD.
Somnolencia como marcador de riesgo cardiovascularEstudios epidemiológicos, donde los pacientes incluidos son mayoritariamente asintomáticos, han demostrado que el SAHS es un factor de riesgo para presentar hipertensión arterial y otros efectos cardiovasculares adversos13,14. Sin embargo, se desconoce si este riesgo se limita a los pacientes con somnolencia.
Choi et al15, que estudiaron a 86 pacientes con SAHS de distinta gravedad y con distintos grados de somnolencia a quienes se realizó una ecografía de impedancia para medir la función cardíaca, encontraron que la puntuación en la escala de Epworth se correlacionaba negativamente con la función cardíaca. De esta manera, los autores señalan que la somnolencia podría ser un método para identificar, dentro del grupo de pacientes con SAHS, a los que presentan el riesgo de desarrollar alteraciones de la función cardíaca.
Se han publicado 2 estudios aleatorizados y controlados sobre el efecto del tratamiento con presión positiva continua de la vía aérea (CPAP) durante la noche en pacientes con SAHS pero sin somnolencia16,17. Ambos estudios encuentran que el tratamiento con CPAP no reduce la presión arterial en estos pacientes, por lo que concluyen que la somnolencia debe de desempeñar un papel importante en la génesis de la hipertensión arterial en estos casos.
Somnolencia: mecanismos de lesión cardiovascularExisten múltiples datos en la literatura médica que demuestran que tanto las citocinas como la proteína C reactiva (PCR), por sí mismas, y la hipoxia, mediante el estrés oxidativo, están íntimamente relacionadas con la génesis de la placa de ateroma18–20. A continuación se analizan las evidencias que relacionan la somnolencia con la hipoxia y el aumento de citocinas proinflamatorias y PCR.
Relación entre hipoxia e hipersomnolenciaZhan et al21,22 demostraron que, al aplicar hipoxia intermitente a un grupo de ratones, disminuye el tiempo en que se mantienen despiertos y aumenta el sueño en fases REM y no REM, al tiempo que disminuye la latencia de sueño. Además, al anular genéticamente a otro grupo de ratones la nicotinamida adenindinucleótido fosfato reducido (NADPH), una enzima que interviene en la producción de radicales libres, observaron que en estos ratones la hipoxia intermitente no produce los mismos cambios en la estructura de sueño. Los autores concluyen que la hipoxia intermitente produce somnolencia mediada por el estrés oxidativo.
Además de los trabajos de Zhan et al, se han realizado otros estudios en animales que demuestran lo mismo y, aunque no se ha demostrado la presencia de daño oxidativo en el cerebro de los pacientes con SAHS, sí se ha demostrado un aumento del estrés oxidativo sistémico y su reducción con el tratamiento con CPAP23.
Relación entre el aumento de citocinas proinflamatorias y la somnolenciaRyan et al24 midieron la concentración de citocinas proinflamatorias en pacientes con distintos grados de gravedad de SAHS y pacientes no apneicos con y sin somnolencia. Se encontró que las citocinas (factor de necrosis tumoral alfa e interleucina-8) están más elevadas en los pacientes con SAHS que en los controles y que su concentración se relaciona con la gravedad del SAHS. Además, entre las personas no apneicas las citocinas están más elevadas en aquellas que refieren somnolencia. Esto indica que la somnolencia, en sí misma, sin necesidad de que haya apneas, puede elevar las citocinas.
En un estudio más reciente se ha analizado el efecto que la medicación neutralizante del factor de necrosis tumoral alfa (etanercept) tiene sobre la somnolencia en pacientes con apneas del sueño25. Se encontró una disminución de la somnolencia 3 veces superior a la observada en pacientes con SAHS a los que se aplicaba tratamiento con CPAP, y los autores señalan que las citocinas proinflamatorias serían mediadores de la somnolencia.
Relación entre la proteína C reactiva y la somnolenciaMeier-Ewert et al26 demostraron en un grupo de sujetos sanos un aumento de la PCR cuando los sometían a privación total o parcial de sueño, así como un incremento tanto de la presión arterial como de la frecuencia cardíaca. Estos autores proponen que la privación de sueño puede ser una de las vías para que se activen los procesos inflamatorios que participan en la génesis de la enfermedad cardiovascular. Somnolencia y enfermedad cardiovascular: datos en contra
Como se ha mencionado anteriormente, la somnolencia se relaciona con una disminución del tono simpático, pero es el aumento de éste lo que se asocia con la morbilidad cardiovascular.
En un estudio reciente Alonso-Fernández et al27 demuestran que el descenso del segmento ST durante la noche en pacientes con SAHS se relaciona con las concentraciones sanguíneas de adrenalina durante el día.
Kaneko et al28 estudiaron a 24 pacientes con SAHS e insuficiencia cardíaca que habían obtenido una puntuación inferior a 10 en la escala de Epworth, y a quienes se administró de forma aleatorizada tratamiento convencional para la insuficiencia cardíaca o tratamiento convencional además de CPAP. Se observó que en los que recibieron CPAP la fracción de eyección aumentó y la presión arterial sistólica disminuyó. Estos datos indican que la somnolencia no desempeña un papel patogénico en la morbilidad cardiovascular de los pacientes con SAHS.
Parra et al29 estudiaron a 161 pacientes con un primer episodio de ictus y una puntuación media (±desviación estándar) en la escala de Epworh de 4,8±3,3. Tras un seguimiento de casi 2 años encontraron un aumento de la mortalidad global en pacientes con un IAH mayor de 30. Esto indica que los pacientes con SAHS que no presentan somnolencia pueden tener un aumento de la mortalidad.
Finalmente, hay varios trabajos en los que no se ha podido demostrar relación alguna entre la somnolencia y el aumento del riesgo cardiovascular. Entre ellos figura el estudio de Saletu et al30, en el que no se encontró correlación entre la somnolencia y las concentraciones de PCR y el grosor íntima-media de la arteria carótida en un grupo de pacientes SAHS. En la misma línea, De la Peña et al31 analizaron las concentraciones de citocinas inflamatorias en afectados de SAHS con y sin somnolencia, sin encontrar diferencias entre ellos.
ConclusionesEl motivo de que algunos pacientes con SAHS que presentan el mismo grado de gravedad experimenten somnolencia y otros no probablemente sea más complejo que los simples datos polisomnográficos. Podríamos pensar en la somnolencia como el nivel final de una balanza en la que se van añadiendo, en un lado, los mecanismos productores del sueño y, en el otro, los inhibidores.
Las consecuencias de que un paciente presente o no somnolencia en el contexto de un SAHS son aún inciertas. Actualmente no hay evidencias suficientes para recomendar el tratamiento en pacientes sin somnolencia, y en la mayoría de los casos éste se limita a los que refieren ESD32. A pesar de lo anterior, en una revisión reciente sobre el tratamiento de pacientes con SAHS sin somnolencia33 se aconseja considerar el tratamiento con CPAP en aquellos casos con importantes repercusiones cardiovasculares, como la hipertensión arterial refractaria.