La hiperinflación dinámica (HD) y la limitación del flujo espiratorio (LFE) están vinculadas fisiológicamente e intervienen en la fisiopatogenia de la disnea y del deterioro de la calidad de vida en la enfermedad pulmonar obstructiva crónica (EPOC). En la EPOC avanzada existe disfunción de los músculos espiratorios, que podría potenciar el desarrollo de HD. El objetivo del presente trabajo ha sido estudiar la relación entre disfunción muscular espiratoria y grado de HD en la EPOC avanzada, y su asociación con disnea y calidad de vida.
Pacientes y métodosEn 25 pacientes determinamos la función pulmonar, la capacidad de esfuerzo (ergometría incremental y prueba de la marcha), la LFE y el volumen telespiratorio (VTE) durante el ejercicio, la función muscular respiratoria, la disnea y la calidad de vida (con el St. George's Respiratory Questionnaire).
ResultadosLos pacientes (volumen espiratorio forzado en el primer segundo del 31% del valor de referencia) tenían moderadamente reducidas la fuerza y la resistencia musculares respiratorias. Diecinueve mostraban LFE en reposo y 24 al 70% de la carga máxima (Wmáx). El VTE aumentó desde el reposo hasta el 70% de la Wmáx (un 9% del valor de referencia de la capacidad vital forzada). Al 70% de la Wmáx el VTE se correlacionó inversamente con la LFE (rho=−0,42), las resistencias musculares inspiratoria (rho=−0,43) y espiratoria (rho=−0,42) y el consumo máximo de oxígeno (rho=−0,52). El incremento del VTE desde reposo hata el 70% de Wmáx se correlacionó con la disnea (rho=0,53), y la LFE al 70% de Wmáx con la escala de actividad del St. George's Respiratory Questionnaire (rho=−0,56). Fueron predictores independientes del VTE al 70% de Wmáx el volumen espiratorio forzado en el primer segundo, la resistencia muscular espiratoria y la LFE.
ConclusionesEn la EPOC avanzada la reducción de la resistencia de los músculos espiratorios está relacionada con mayor HD (y menor LFE) durante el ejercicio, lo que se asocia a mayor disnea y peor calidad de vida.
Dynamic hyperinflation (DH) and expiratory flow limitation (EFL) are physiologically linked and seem to be involved in the genesis of dyspnea and the quality of life (QL) impairment in chronic obstructive pulmonary disease (COPD). Advanced COPD patients often show expiratory muscles dysfunction that could be involved in DH development. Aim: Study the relationships between expiratory muscle dysfunction and DH, and their association with dyspnea and QL, in advanced COPD.
Patients and methodsIn 25 patients we measured lung function, exercise capacity (incremental ergometry and walking test), EFL and end-expiratory lung volume (EELV) at rest and during exercise, respiratory muscles strength and endurance, dyspnea and QL (Saint George Respiratory Questionnaire, SGRQ).
ResultsThe patients (mean FEV1=31% predicted) showed a moderate decrease of respiratory muscles strength and endurance. Nineteen patients exhibited EFL at rest and 24 at 70% of maximal workload (Wmax). The EELV increased from rest to 70% Wmax (9% of predicted FVC). At 70% Wmax EELV correlated inversely with the EFL amount (rho=−0.42), the inspiratory and expiratory muscles endurance (rho=−0.43 and −0.42 respectively) and y VO2max (rho=−0.52). The EELV increase from resting to 70% Wmax correlated with dyspnea (rho=0.53) and the amount of EFL at 70%Wmax with the activity score of SGRQ. The FEV1, expiratory muscles endurance and LFE amount were independent predictors of EELV at 70% Wmax.
ConclusionsIn advanced COPD a poorer expiratory muscles endurance is related with higher DH during exercise (and lower EFL), which is correlated with higher dyspnea and worse QL.
En la enfermedad pulmonar obstructiva crónica (EPOC) la hiperinflación dinámica (HD) está implicada en el desarrollo de disnea y limitación de la capacidad de ejercicio. En los últimos años se ha reconocido que la capacidad inspiratoria (CI), como medida de HD, constituye una variable de relevancia clínica y pronóstica en la EPOC1. La HD tiene repercusiones fisiológicas negativas (disminución de la eficiencia del diafragma, aumento del trabajo elástico de la respiración y alteración de la función diastólica cardíaca), pero también positivas (a mayor volumen pulmonar el flujo espiratorio máximo es superior y se produce la apertura de las pequeñas vías aéreas, que mejora la distribución de la ventilación y disminuye el trabajo resistivo respiratorio), aunque el balance de estos efectos resulta negativo en términos de disnea y tolerancia al ejercicio2–4.
El principal mecanismo implicado en el desarrollo de la HD en la EPOC es la limitación del flujo espiratorio (LFE). La reducción de los flujos espiratorios máximos, característica de dicha enfermedad, favorece que éstos se alcancen, de modo que se pone de manifiesto la LFE incluso durante la respiración espontánea en reposo5,6. La LFE constituye per se un límite tanto para la ventilación máxima como para la capacidad de ejercicio7 y, dado que limita la velocidad de vaciado pulmonar, favorece el desarrollo de HD8. Al ser la HD y la LFE fenómenos interrelacionados (la LFE induce HD, y el incremento de volumen, a su vez, disminuiría el segmento de la curva flujo-volumen que alcanza la LFE), resulta difícil separar las repercusiones de cada una de ellas.
Mientras que durante el ejercicio los individuos sanos reducen generalmente su volumen telespiratorio (VTE) hasta alcanzar el máximo consumo de oxígeno9, los pacientes con EPOC pueden mostrar distintos patrones: sin HD; HD precoz, o HD tardía10,11. Estos patrones, cuyas repercusiones clínicas no están claras, se han atribuido a posibles diferencias en la limitación impuesta por el grado de LFE, pero en los estudios citados no se midió el porcentaje de LFE10,11.
Se ha planteado que en el desarrollo de la HD durante el ejercicio en pacientes con EPOC evolucionada podría estar implicada una menor actividad de la musculatura espiratoria11. En efecto, los hallazgos de HD en ausencia de LFE global2,7, y de LFE sin desarrollo de HD12, ponen en evidencia que otros mecanismos, además de la LFE, deben de intervenir en el desarrollo de la HD. Entre ellos probablemente habría algunos dependientes de los músculos inspiratorios, pero la debilidad de los músculos de la prensa abdominal, los principales con acción espiratoria, también podría dificultar el vaciado pulmonar2. En personas sanas existe un margen amplio entre la presión espiratoria máxima (PEmáx) y las presiones alcanzadas durante el ejercicio, y este hecho, extrapolado a la EPOC, junto con la existencia en esta enfermedad de un bajo “techo” para el flujo espiratorio debido a la LFE, llevó a considerar improbable que los músculos espiratorios estuvieran implicados de manera relevante en el desarrollo de HD durante el ejercicio en los pacientes afectados13. Sin embargo, posteriormente se ha demostrado que los pacientes con EPOC evolucionada reclutan los músculos de la prensa abdominal incluso en reposo, y que éstos frecuentemente presentan una disfunción que reduce su fuerza y principalmente su resistencia, al igual que ocurre con otros grupos musculares en el marco de la afectación sistémica asociada a la EPOC14. Los datos de la literatura médica respecto al papel de los músculos espiratorios en la respuesta ventilatoria al ejercicio en la EPOC son escasos, muy por debajo de los referentes a la musculatura inspiratoria y especialmente al diafragma.
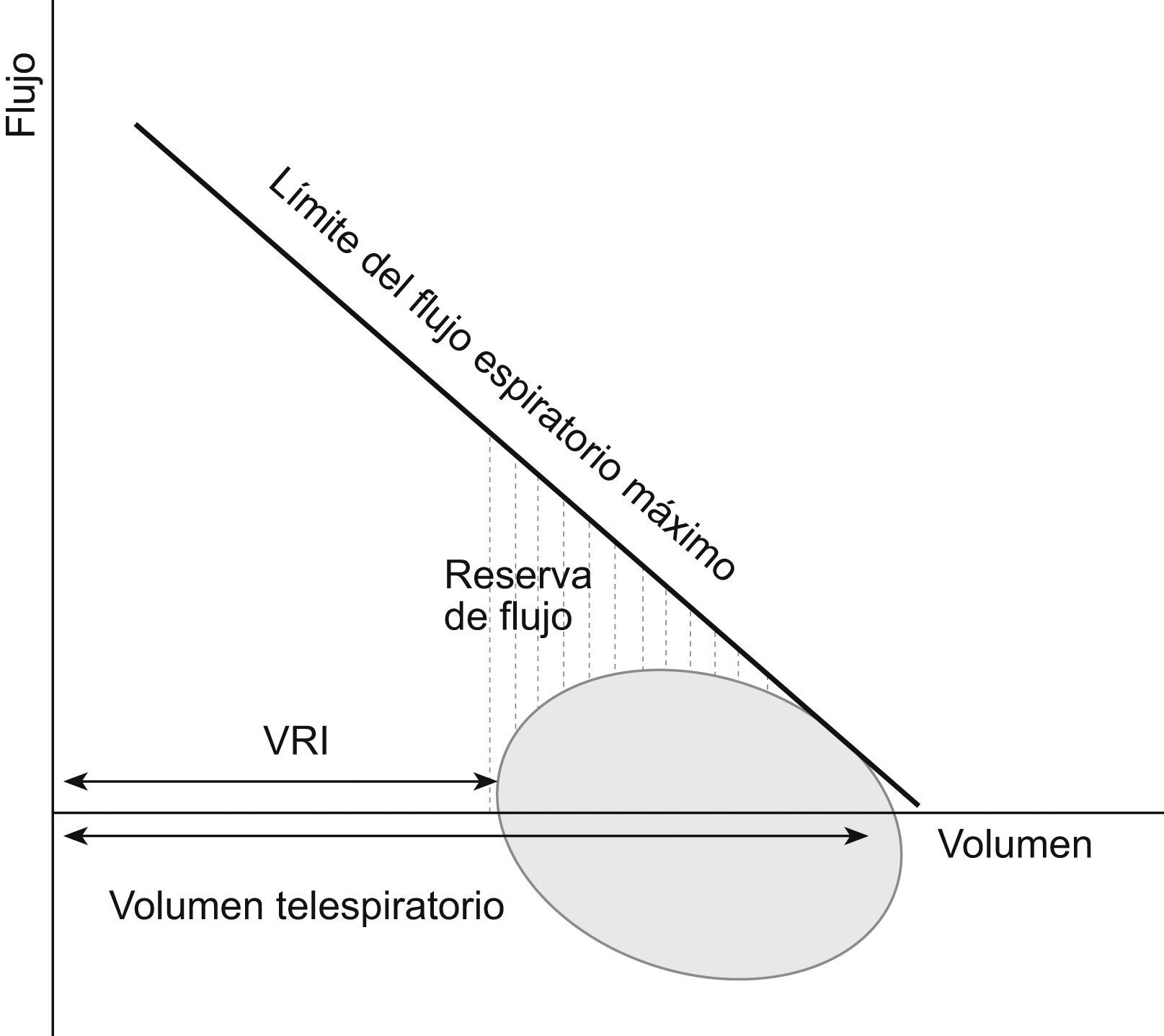
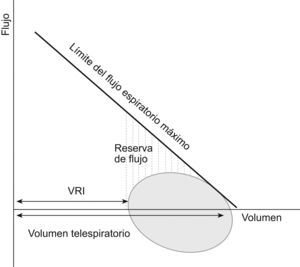
Nuestro objetivo ha sido investigar si existe una relación entre la HD durante el ejercicio y la función de los músculos espiratorios que apoye el posible papel de esta última en el desarrollo de HD en la EPOC avanzada, teniendo presente que los pacientes con obstrucción intensa tienen una alta probabilidad de alcanzar la situación de LFE durante el ejercicio y que esto promoverá el incremento del VTE, es decir, la HD. En segundo lugar, nos planteamos estudiar las posibles implicaciones clínicas sobre la capacidad de esfuerzo, disnea y calidad de vida relacionada con la salud. En otras palabras, nos preguntamos si los pacientes con EPOC grave o muy grave utilizan todas sus reservas de flujo espiratorio (LFE) o usan precozmente su volumen de reserva inspiratorio (HD) para incrementar la ventilación durante el ejercicio (fig. 1), si la función de los músculos espiratorios parece tener un papel en la estrategia ventilatoria utilizada y qué implicaciones clínicas se asocian con ella.
Representación esquemática de una curva flujo-volumen en respiración espontánea. El flujo espiratorio (positivo en la gráfica) puede incrementarse utilizando la reserva de flujo hasta alcanzar el límite del flujo espiratorio máximo, momento en el que se presenta el fenómeno de limitación del flujo espiratorio en la parte correspondiente de la curva flujo-volumen. La opción alternativa es usar el volumen de reserva inspiratorio (VRI) e incrementar el volumen telespiratorio desarrollando hiperinflación dinámica, lo que permite incrementar el flujo espiratorio sin alcanzar la situación de limitación del flujo espiratorio. En presencia de limitación máxima del flujo espiratorio (cercana al 100% del volumen circulante), la única opción es la hiperinflación dinámica.
Se incluyó a pacientes diagnosticados de EPOC clínicamente estables con volumen espiratorio forzado en el primer segundo (FEV1) inferior al 50% del valor de referencia, seleccionados de manera sucesiva de entre los que esperaban iniciar un programa de rehabilitación respiratoria en los centros participantes. La mayor parte de ellos participaron simultáneamente en otros proyectos de investigación sobre el entrenamiento muscular en la EPOC, parte de cuyos resultados han sido ya publicados15,16. El protocolo del estudio fue aprobado por los comités éticos de nuestras instituciones y todos los pacientes dieron su consentimiento informado. Se excluyó a los pacientes que presentaron un incremento del FEV1 superior a 400ml tras la administración de 200μg de salbutamol inhalado, una saturación de la hemoglobina menor del 90%, un índice de masa corporal inferior a 20 o mayor de 35kg/m2 y comorbilidad significativa: enfermedad neoplásica, cardiovascular, neuromuscular, osteoarticular o metabólica que pudiera interferir en los resultados, enolismo o desnutrición graves, tratamiento farmacológico con potencial efecto sobre la función muscular (p. ej., teofilina, corticoides sistémicos). Para excluir el síndrome de apnea-hipopnea obstructiva del sueño se evaluaron síntomas y se realizó una pulsioximetría nocturna. Las mediciones del estudio, que se describen a continuación, se realizaron en 2–3 días consecutivos.
Antropometría, fuerza del cuádriceps y función pulmonarSe determinaron el peso, la altura, la circunferencia braquial y el pliegue tricipital (en el tercio medio braquial), así como dinamometría del cuádriceps (en el miembro no dominante). Se realizaron, de acuerdo con las normativas vigentes, espirometría forzada y medida de la ventilación voluntaria máxima en 12s mediante un espirómetro con pneumotacómetro tipo Fleisch (Datospir 92®, Sibelmed, Barcelona, España), así como medición de volúmenes estáticos por pletismografía corporal y de la transferencia del monóxido de carbono (método de respiración única, Datalab 500®, Sensor-Medics, Yorba Linda, CA, EE.UU.). Se utilizaron valores de referencia para población mediterránea17,18.
Fuerza y resistencia de los músculos respiratoriosLas presiones inspiratoria y espiratoria máximas (PImáx, desde volumen residual, y PEmáx, desde la capacidad pulmonar total) se determinaron con un manómetro 192® (Sibelmed, Barcelona, España) y se compararon con valores de referencia de Morales et al19. La resistencia de los músculos respiratorios se evaluó mediante la determinación de las presiones inspiratoria o espiratoria alcanzadas durante sendos tests de carga incremental con válvulas dintel (PIthmáx y PEthmáx, respectivamente) y con la medida del tiempo durante el cual se toleró una carga inspiratoria o espiratoria equivalente al 80% de la PIthmáx o PEthmáx (TIth80 y TEh80, respectivamente). Las técnicas, el equipo y los valores de referencia se han descrito previamente con detalle14,20,21.
Prueba de esfuerzo incrementalSe realizó una cicloergometría incremental (Collins-CPX®, Braintree, MA, EE.UU.) limitada por síntomas con incrementos de 16W/min22, durante la que se controlaron electrocardiograma, parámetros ventilatorios, oxígeno y anhídrido carbónico en aire espirado respiración a respiración y saturación de hemoglobina por pulsioximetría. Se determinaron la disnea y el malestar en las extremidades inferiores (escala de Borg modificada) cada 2min durante la prueba.
Determinación de la limitación del flujo espiratorio y del volumen telespiratorio durante el ejercicioSe realizaron sendas cicloergometrías submáximas al 50 y al 70% de la carga máxima alcanzada en la prueba incremental. En reposo, con el paciente en sedestación sobre el cicloergómetro y tras 3min de pedaleo con cada una de las cargas, se determinó la presencia de LFE y se cuantificó el porcentaje del volumen corriente afectado por ella (%VT) mediante la aplicación de presión negativa espiratoria (técnica de NEP) y los cambios en el VTE mediante la determinación de la CI5,23. El equipo usado se describió en detalle en un estudio anterior9. Brevemente, la técnica de NEP consiste en comparar por superposición la curva flujo-volumen en que se aplica la NEP (3 cmH2O) con la del ciclo respiratorio precedente, definiéndose la LFE como la coincidencia de un segmento de la curva con el de la respiración control (una diferencia en el flujo<0,07 l/s se consideró despreciable)24. Se realizaron al menos 3 medidas en cada nivel de ejercicio estudiado, conectándose en cada una el paciente al sistema mediante una boquilla cilíndrica y registrando gráficamente las curvas flujo-volumen a tiempo real mediante un programa informático modificado al efecto (Datospir 500®, Sibelmed, Barcelona, España). La NEP se activó una vez regularizado el patrón respiratorio, inmediatamente después del inicio de la espiración, y se mantuvo hasta la finalización de ésta. Se rechazaron las maniobras con artefactos y aquellas en que el flujo en el ciclo con NEP estaba por debajo del de la curva control (indicativas de un un colapso parcial de la vía aérea superior).
Se obtuvieron también 3 maniobras de CI en cada nivel de ejercicio usando el mismo equipo como medida del VTE, que se expresó como porcentaje de la capacidad vital forzada (FVC) de referencia para normalizar su valor (VTE=1 – (FVC ref. – CI) × 100/FVC ref.), de modo que un VTE del 100% correspondería a la capacidad pulmonar total y un incremento del mismo indica HD. Las maniobras de CI se consideraron correctas si no se detectaban un esfuerzo insuficiente o artefactos en las mismas, y si la variabilidad intermaniobra era inferior a 150ml. Se calculó el promedio de las variables de patrón respiratorio, LFE (%VT) y CI de las maniobras técnicamente correctas3.
Prueba de la marcha de 6minSe valoró la mejor de 2 pruebas realizadas de acuerdo con la normativa vigente, durante las cuales se registraron la saturación de hemoglobina y la frecuencia cardíaca mediante pulsioximetría, evaluándose además la disnea percibida inicial y final (escala de Borg modificada).
Disnea y calidad de vida relacionada con la saludLa disnea relacionada con las actividades de la vida diaria se evaluó mediante la escala del Medical Research Council (MRC) modificada (0: ausente; 4: muy intensa)25. La calidad de vida relacionada con la salud (CVRS) se midió con el St. George's Respiratory Questionnaire (SGRQ)26, en que se puntúan las escalas de síntomas, actividad, impacto y global, cada una de 0 a 100 (de ausencia a máxima alteración en la CVRS).
Análisis estadísticoLos valores, excepto que se indique lo contrario, se expresan como media aritmética y error estándar. Para las comparaciones intergrupo se utilizó la prueba de la U de Mann-Whitney, y para las comparaciones intragrupo el test de Wilcoxon o la ANOVA de una vía con el test post hoc de Duncan. La correlación entre variables se analizó mediante el cálculo del coeficiente rho de Spearman. La relación de las variables de función muscular respiratoria con las clínicas, LFE y HD se evaluó mediante el cálculo de los coeficientes de correlación parcial, controlando las variables significativas en el estudio de correlación simple. Se realizó una regresión lineal múltiple (método escalonado hacia delante) para seleccionar las variables predictoras independientes del VTE durante el ejercicio de entre las antropométricas y de función pulmonar y muscular respiratoria. Se consideró significativo un valor de p<0,05.
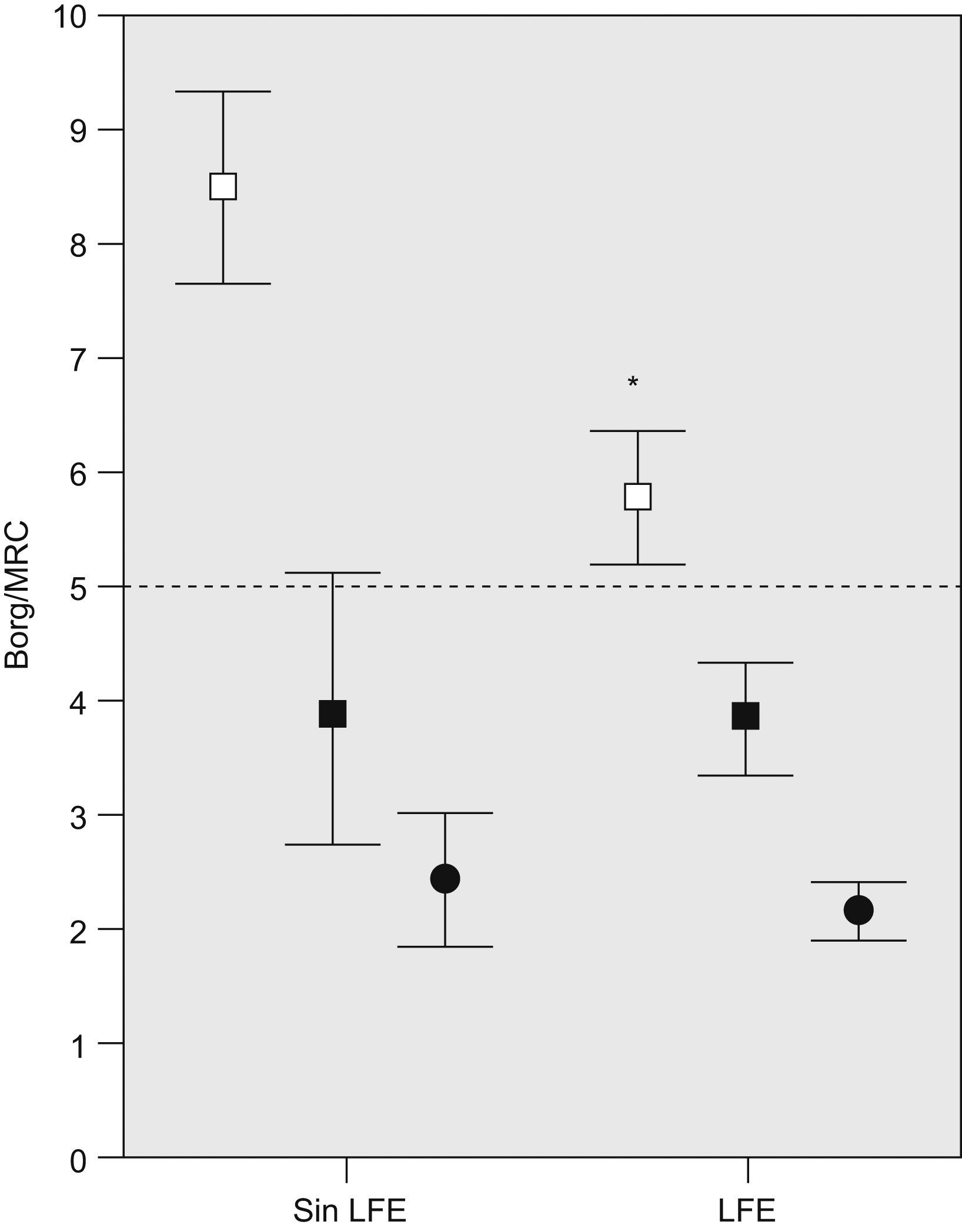
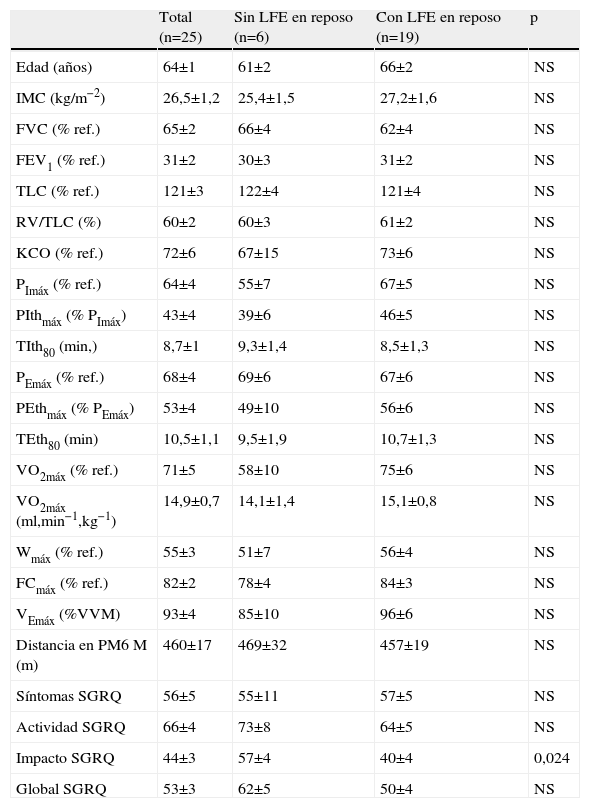
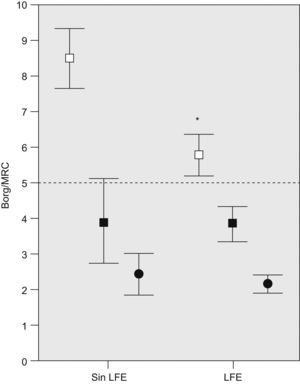
ResultadosCaracterísticas de los pacientesSe incluyó a 25 pacientes, cuyas características principales se muestran en la tabla 1. La CI del grupo estaba reducida (media±error estándar: 77±4% del valor de referencia), lo que denota cierta hiperinflación ya durante la respiración tranquila en reposo (tabla 2). Diecinueve (76%) mostraron LFE en reposo (46±5%VT; rango: 15–71%). Los pacientes sin LFE en reposo referían mayor disnea en el ejercicio máximo (fig. 2) y puntuaron más en la escala de impacto del SGRQ, sin otras diferencias estadísticamente significativas en variables antropométricas, clínicas y funcionales.
Características principales de los pacientes
| Total (n=25) | Sin LFE en reposo (n=6) | Con LFE en reposo (n=19) | p | |
| Edad (años) | 64±1 | 61±2 | 66±2 | NS |
| IMC (kg/m−2) | 26,5±1,2 | 25,4±1,5 | 27,2±1,6 | NS |
| FVC (% ref.) | 65±2 | 66±4 | 62±4 | NS |
| FEV1 (% ref.) | 31±2 | 30±3 | 31±2 | NS |
| TLC (% ref.) | 121±3 | 122±4 | 121±4 | NS |
| RV/TLC (%) | 60±2 | 60±3 | 61±2 | NS |
| KCO (% ref.) | 72±6 | 67±15 | 73±6 | NS |
| PImáx (% ref.) | 64±4 | 55±7 | 67±5 | NS |
| PIthmáx (% PImáx) | 43±4 | 39±6 | 46±5 | NS |
| TIth80 (min,) | 8,7±1 | 9,3±1,4 | 8,5±1,3 | NS |
| PEmáx (% ref.) | 68±4 | 69±6 | 67±6 | NS |
| PEthmáx (% PEmáx) | 53±4 | 49±10 | 56±6 | NS |
| TEth80 (min) | 10,5±1,1 | 9,5±1,9 | 10,7±1,3 | NS |
| VO2máx (% ref.) | 71±5 | 58±10 | 75±6 | NS |
| VO2máx (ml,min−1,kg−1) | 14,9±0,7 | 14,1±1,4 | 15,1±0,8 | NS |
| Wmáx (% ref.) | 55±3 | 51±7 | 56±4 | NS |
| FCmáx (% ref.) | 82±2 | 78±4 | 84±3 | NS |
| VEmáx (%VVM) | 93±4 | 85±10 | 96±6 | NS |
| Distancia en PM6M (m) | 460±17 | 469±32 | 457±19 | NS |
| Síntomas SGRQ | 56±5 | 55±11 | 57±5 | NS |
| Actividad SGRQ | 66±4 | 73±8 | 64±5 | NS |
| Impacto SGRQ | 44±3 | 57±4 | 40±4 | 0,024 |
| Global SGRQ | 53±3 | 62±5 | 50±4 | NS |
Valores expresados como media±error estándar.
FCmáx: frecuencia cardíaca máxima en la cicloergometría incremental; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; KCO: factor de difusión del monóxido de carbono dividido entre el volumen alveolar; LFE: limitación del flujo espiratorio; MRC: escala del Medical Research Council modificada; NS: diferencia no significativa (p<0,05) entre grupos; PEmáx: presión espiratoria máxima; PEthmáx: presión espiratoria máxima en la prueba de carga incremental; PImáx: presión inspiratoria máxima; PIthmáx: presión inspiratoria máxima en la prueba de carga incremental; PM6M: prueba de la marcha de 6min; RV: volumen residual; SGRQ: St. George's Respiratoty Questionnaire; TEth80: tiempo de ventilación sostenida frente a una carga espiratoria del 80% de la PEthmáx; TIth80: tiempo de ventilación sostenida frente a una carga inspiratoria del 80% de la PIthmáx; TLC: capacidad pulmonar total; VCO2máx: producción de anhídrido carbónico en el momento de máximo ejercicio; VEmáx (%VVM): ventilación máxima en la cicloergometría incremental (porcentaje de la ventilación voluntaria máxima); VO2máx: consumo máximo de oxígeno; Wmáx: carga máxima.
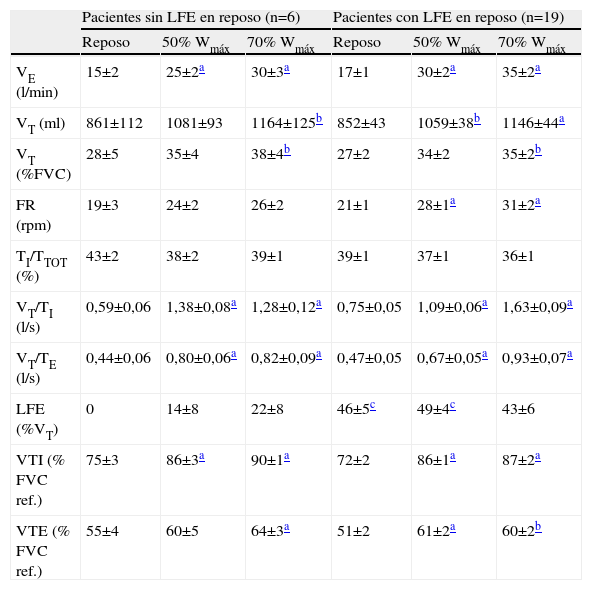
Variables ventilatorias en reposo y durante el ejercicio
| Pacientes sin LFE en reposo (n=6) | Pacientes con LFE en reposo (n=19) | |||||
| Reposo | 50% Wmáx | 70% Wmáx | Reposo | 50% Wmáx | 70% Wmáx | |
| VE (l/min) | 15±2 | 25±2a | 30±3a | 17±1 | 30±2a | 35±2a |
| VT (ml) | 861±112 | 1081±93 | 1164±125b | 852±43 | 1059±38b | 1146±44a |
| VT (%FVC) | 28±5 | 35±4 | 38±4b | 27±2 | 34±2 | 35±2b |
| FR (rpm) | 19±3 | 24±2 | 26±2 | 21±1 | 28±1a | 31±2a |
| TI/TTOT (%) | 43±2 | 38±2 | 39±1 | 39±1 | 37±1 | 36±1 |
| VT/TI (l/s) | 0,59±0,06 | 1,38±0,08a | 1,28±0,12a | 0,75±0,05 | 1,09±0,06a | 1,63±0,09a |
| VT/TE (l/s) | 0,44±0,06 | 0,80±0,06a | 0,82±0,09a | 0,47±0,05 | 0,67±0,05a | 0,93±0,07a |
| LFE (%VT) | 0 | 14±8 | 22±8 | 46±5c | 49±4c | 43±6 |
| VTI (% FVC ref.) | 75±3 | 86±3a | 90±1a | 72±2 | 86±1a | 87±2a |
| VTE (% FVC ref.) | 55±4 | 60±5 | 64±3a | 51±2 | 61±2a | 60±2b |
Valores expresados como media±error estándar.
FR: frecuencia respiratoria; LFE: limitación del flujo espiratorio; TI/TTOT: tiempo inspiratorio dividido entre el tiempo total del ciclo respiratorio; VE: ventilación; VT/TE: flujo espiratorio medio; VT/TI: flujo inspiratorio medio; VT: volumen corriente; VTE: volumen telespiratorio; VTI: volumen teleinspiratorio; Wmáx: carga máxima en el ejercicio incremental.
Comparación de las variables de disnea entre los individuos con y sin limitación del flujo espiratorio (LFE) en reposo: disnea media al final de la cicloergometría incremental (cuadrados vacíos) y al final de la prueba de la marcha de 6min (cuadrados negros) medida con la escala de Borg; disnea media según la escala del Medical Research Council (MRC) modificada (círculos negros; la línea de puntos indica el límite máximo de la escala). Las líneas representan el error estándar. *p<0,05 entre grupos.
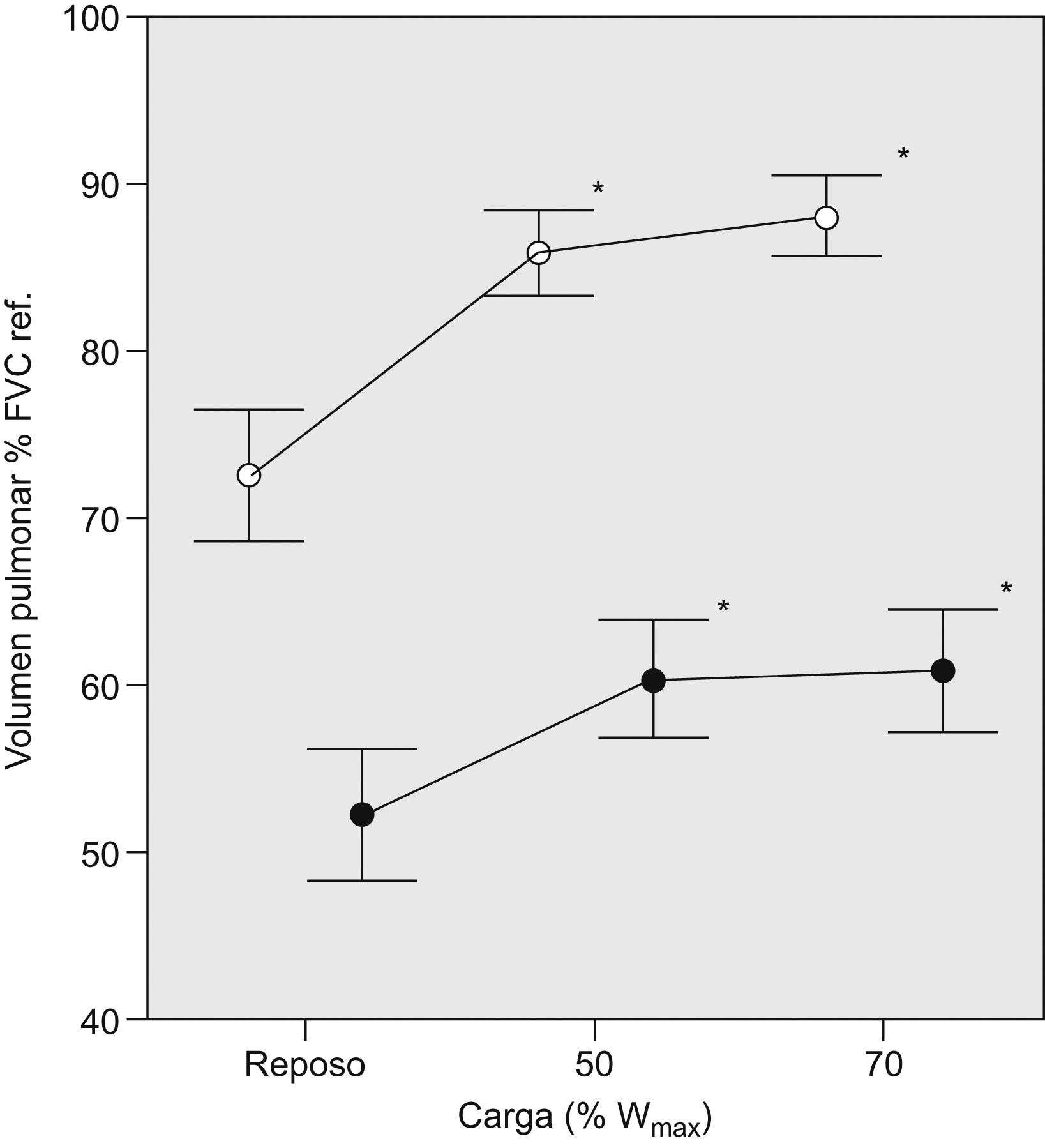
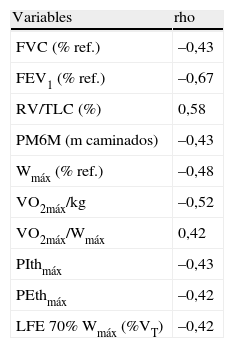
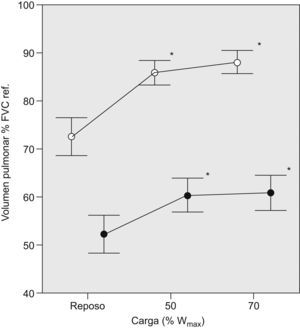
En la tabla 2 se muestran las variables ventilatorias antes del ejercicio y en los 2 niveles de carga de esfuerzo submáximo estudiados. El conjunto de pacientes presentó HD progresiva durante el ejercicio, de manera similar aquéllos con y sin LFE en reposo (tabla 2 y fig. 3), con un incremento del VTE promedio de reposo al 70% de la carga máxima (Wmáx) de 0,388l (rango: −0,15 a 1,03l). Dividimos a los pacientes según el incremento del VTE durante el ejercicio fuera menor o mayor de 150ml, que de acuerdo con la variabilidad de la técnica es el dintel de cambio que adoptamos para definir la HD. En 20 casos (84%) observamos HD3. Los 5 pacientes que no desarrollaron HD no se diferenciaron significativamente, en las variables estudiadas, de aquellos que sí la presentaron. Tres de ellos tenían un nivel importante de LFE (> 50%VT) tanto en situación basal como durante el ejercicio (FEV1 del 26 y el 38% del valor de referencia, respectivamente), uno sólo mostró LFE al 70% de la Wmáx (32%VT, FEV1 del 38% del valor de referencia) y el último fue el único en que no se detectó LFE a ninguno de los niveles estudiados y mostró el mayor VTE en reposo de los 20 pacientes (un 55% de la FVC de referencia; FEV1 del 21% del valor de referencia; coeficiente de difusión del monóxido de carbono —factor de difusión del monóxido de carbono dividido entre el volumen alveolar— del 15% del valor de referencia, y consumo máximo de oxígeno del 18% del valor de referencia). Los pacientes que presentaron una mayor HD en proporción al incremento de la ventilación con el ejercicio alcanzaron un VTE mayor, como era de esperar (ΔVTE /Δventilación se correlacionó con el VTE al 70% de la Wmáx en valor absoluto; rho=−0,59, p=0,04). El VTE al 70% de la Wmáx se correlacionó inversamente con la LFE al 70% de la Wmáx (tabla 3).
Evolución de los volúmenes pulmonares según la carga de esfuerzo en los 25 pacientes. El 100% de la capacidad vital forzada (FVC) corresponde al volumen pulmonar total. Los puntos representan el promedio de los pacientes (vacíos para el volumen teleinspiratorio, negros para el telespiratorio) y las líneas de intervalo, el error estándar en cada caso. La distancia entre volúmenes teleinspiratorio y telespiratorio para cada nivel de carga representa el volumen circulante. %Wmáx: porcentaje de carga máxima. *p<0,05 respecto al valor en reposo.
Correlaciones significativas del volumen telespiratorio durante el ejercicio al 70% de la carga máxima
| Variables | rho |
| FVC (% ref.) | –0,43 |
| FEV1 (% ref.) | –0,67 |
| RV/TLC (%) | 0,58 |
| PM6M (m caminados) | –0,43 |
| Wmáx (% ref.) | –0,48 |
| VO2máx/kg | –0,52 |
| VO2máx/Wmáx | 0,42 |
| PIthmáx | –0,43 |
| PEthmáx | –0,42 |
| LFE 70% Wmáx (%VT) | –0,42 |
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; LFE 70% Wmáx (%VT): limitación del flujo espiratorio en porcentaje del volumen circulante; PEthmáx: presión espiratoria máxima tolerada en la prueba de carga incremental; PIthmáx: presión inspiratoria máxima tolerada en la prueba de carga incremental; PM6M: prueba de la marcha de 6min; VO2máx: consumo máximo de oxígeno; Wmáx: carga máxima en la prueba de ejercicio incremental. Para todas las correlaciones, p<0,05.
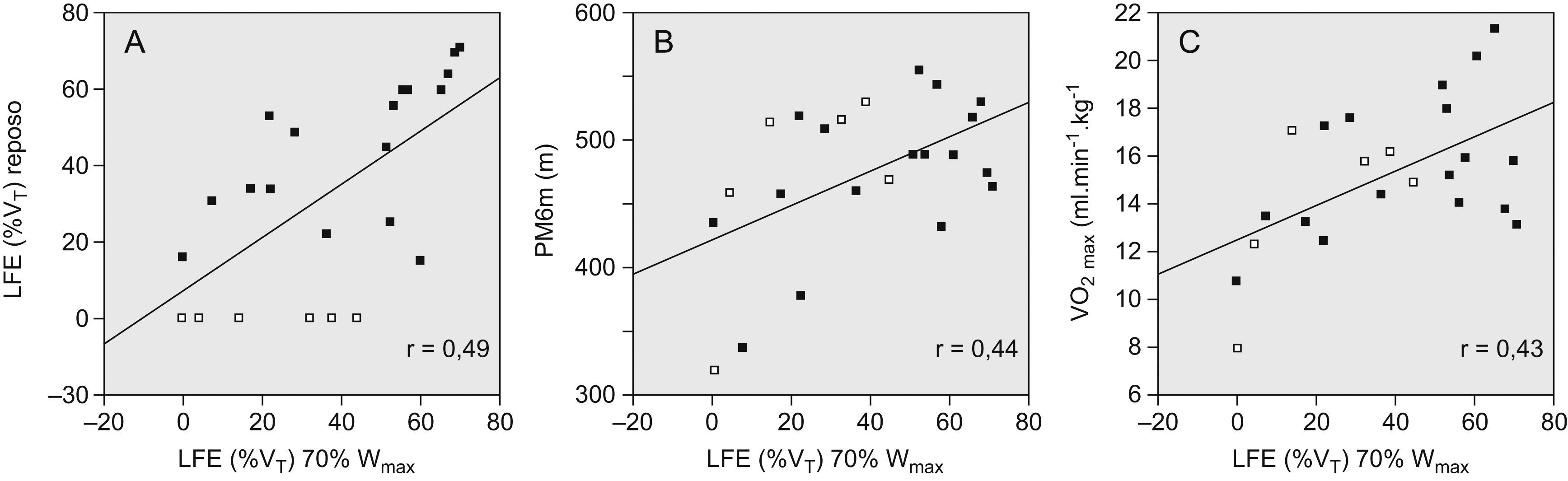
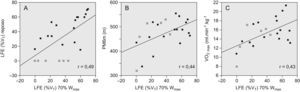
El nivel inicial de LFE se mantuvo o se incrementó con el ejercicio (tabla 2), excepto en 6 pacientes, cuya única característica distintiva fue una PEthmáx significativamente inferior a la de los restantes (56±8 frente a 71±6 cmH2O; p=0,013, y un 43±2 frente al 56±5% de la PEmáx; p=0,005). De los pacientes sin LFE en reposo, 3 persistían sin ella al 50% de la Wmáx y sólo uno al 70% de la Wmáx (véase descripción de éste en el párrafo anterior). La LFE en reposo y la LFE al 70% de la Wmáx se correlacionaron significativamente, aunque con una considerable dispersión de los datos (fig. 4A).
Relación de la limitación del flujo espiratorio (LFE) durante el ejercicio al 70% de la carga máxima (Wmáx) con la LFE en reposo (A), la distancia caminada en la prueba de la marcha de 6min (PM6M) (B) y el consumo máximo de oxígeno (VO2máx) (C). Se muestran las rectas de regresión lineal. Los cuadrados vacíos representan los pacientes sin LFE en reposo, mientras que los negros corresponden a los pacientes con LFE en reposo. %VT: porcentaje del volumen corriente afectado por la LFE. r: coeficiente de correlación de Spearman (en todos casos, p<0,05).
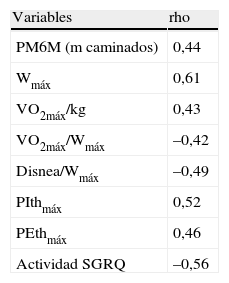
El nivel de LFE al 70% de la Wmáx se correlacionó con mayor capacidad de esfuerzo, menor disnea y mejor función de los músculos respiratorios (tabla 4 y figs. 4B y C). El ΔVTE durante el ejercicio (desde el valor de reposo al observado al 70% de la Wmáx) se correlacionó positivamente con la disnea evaluada con la escala MRC (rho=0,53; p=0,008), y un mayor VTE al 70% de la Wmáx se asoció a mayor obstrucción y atrapamiento aéreo, menor capacidad de esfuerzo, menor resistencia de los músculos inspiratorios y espiratorios y, como ya se ha dicho, mayor LFE al 70% de la Wmáx (tablas 3 y 4).
Correlaciones significativas del porcentaje de limitación espiratoria del flujo aéreo durante el ejercicio al 70% de la carga máxima
| Variables | rho |
| PM6M (m caminados) | 0,44 |
| Wmáx | 0,61 |
| VO2máx/kg | 0,43 |
| VO2máx/Wmáx | –0,42 |
| Disnea/Wmáx | –0,49 |
| PIthmáx | 0,52 |
| PEthmáx | 0,46 |
| Actividad SGRQ | –0,56 |
disnea/Wmáx: puntuación en disnea al final de la prueba de esfuerzo incremental (Borg) dividida entre la carga máxima; PEthmáx: presión espiratoria máxima tolerada en la prueba de carga incremental; PIthmáx: presión inspiratoria máxima tolerada en la prueba de carga incremental; PM6M: prueba de la marcha de 6min; VO2máx: consumo máximo de oxígeno; Wmáx: carga máxima en la prueba de ejercicio incremental.
Para todas las correlaciones, p<0,05.
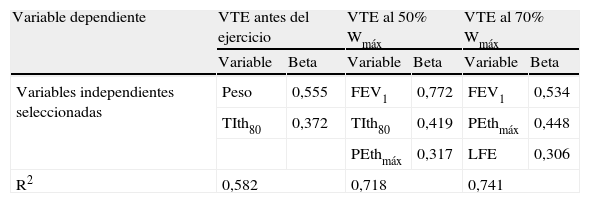
En el análisis multivariante (tabla 5) se seleccionaron el FEV1, PEthmáx y nivel de LFE al 70% de la Wmáx como variables independientes explicativas de la variabilidad del VTE al 70% del Wmáx (R2 del modelo=0,74).
Regresión lineal múltiple para el volumen telespiratorio
| Variable dependiente | VTE antes del ejercicio | VTE al 50% Wmáx | VTE al 70% Wmáx | |||
| Variable | Beta | Variable | Beta | Variable | Beta | |
| Variables independientes seleccionadas | Peso | 0,555 | FEV1 | 0,772 | FEV1 | 0,534 |
| TIth80 | 0,372 | TIth80 | 0,419 | PEthmáx | 0,448 | |
| PEthmáx | 0,317 | LFE | 0,306 | |||
| R2 | 0,582 | 0,718 | 0,741 | |||
FEV1: volumen espiratorio forzado en el primer segundo; LFE: limitación del flujo espiratorio; PEthmáx: presión espiratoria máxima tolerada en la prueba de carga incremental; PM6M: prueba de la marcha de 6min; TIth80: ventilación sostenida frente una carga inspiratoria del 80% de la alcanzada en la prueba incremental; VTE: volumen telespiratorio; Wmáx: carga máxima en la prueba de ejercicio incremental.
Un valor positivo de beta indica asociación con menor proximidad a la capacidad pulmonar total (menor hiperinflación dinámica).
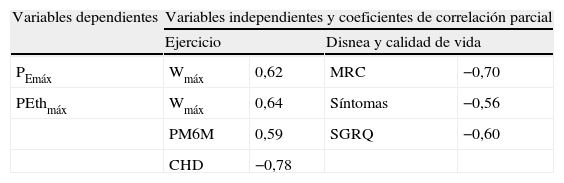
En la tabla 6 se muestran las correlaciones significativas de la función de los músculos espiratorios tras ajustar según la edad, altura, peso, FVC, FEV1, coeficiente de difusión del monóxido de carbono, PImáx y PIthmáx,.
Correlaciones parciales significativas de la función de los músculos espiratorios
| Variables dependientes | Variables independientes y coeficientes de correlación parcial | |||
| Ejercicio | Disnea y calidad de vida | |||
| PEmáx | Wmáx | 0,62 | MRC | −0,70 |
| PEthmáx | Wmáx | 0,64 | Síntomas | −0,56 |
| PM6M | 0,59 | SGRQ | −0,60 | |
| CHD | −0,78 | |||
CHD: coeficiente de hiperinflación dinámica (incremento del volumen telespiratorio dividido por el incremento en la ventilación durante el ejercicio entre el 50 y el 70% de la carga máxima en la prueba de ejercicio incremental); MRC: Medical Research Council; PEmáx: presión espiratoria máxima; PEthmáx : presión espiratoria máxima tolerada en la prueba de carga incremental; PM6M: distancia caminada en la prueba de la marcha de 6min; SGRQ: Saint George Respiratory Questionnaire; Wmáx: carga máxima en la prueba de ejercicio incremental.
Para todas las correlaciones, p<0,05.
Los principales hallazgos del presente estudio son que en pacientes con EPOC grave o muy grave: a) la LFA y la HD se presentan muy frecuentemente durante el ejercicio submáximo, pero lo hacen en grados muy variables y están inversamente relacionados en magnitud; b) la resistencia de los músculos espiratorios guarda una relación inversa con la HD durante el ejercicio, de la que es un predictor independiente, y c) la presencia de LFE en reposo no implica más disnea o peor capacidad de esfuerzo o CVRS en estos pacientes, mientras que un mayor porcentaje de LFE durante el ejercicio se relaciona con menos disnea y mejor capacidad de ejercicio y CVRS, asociación posiblemente mediada por el desarrollo de menor HD.
La mayoría de los pacientes presentaban LFE en reposo, tal como era de esperar dada la gravedad de la EPOC (margen de FEV1: 19–48% del valor de referencia), que creemos explica la mayor prevalencia de LFE respecto a otras series publicadas5,6,27. Sin embargo, la gran variabilidad interindividual en el porcentaje del volumen corriente sometido a LFE, a pesar de la aparente homogeneidad de la muestra respecto al resto de variables de función pulmonar, evidencia que el grado de LFE es el resultado de la interacción de diversos factores además del grado de obstrucción y la resistencia al flujo, entre los cuales se encuentran sin duda la distensibilidad de la caja torácica y pulmonar y el patrón ventilatorio2,6–8,13. Asimismo, nuestros pacientes mostraron en reposo hiperinflación y atrapamiento aéreo moderados, independientemente de si presentaban o no LFE, siendo la CI comparable entre aquellos que estaban o no en situación de LFE en reposo (un 80% del valor de referencia aquéllos con LFE frente al 76% del valor de referencia en aquéllos sin LFE). Si el incremento del VTE fuera un fenómeno de respuesta “obligada” al límite impuesto por la LFE, no debería observarse hiperinflación en ausencia de LFE. Esto indica que hay otros mecanismos implicados en el incremento de volumen pulmonar2,8, del mismo modo que en pacientes con asma la respuesta a la broncoconstricción se puede traducir en hiperinflación en ausencia de LFE28. Nosotros no fuimos capaces de encontrar diferencias funcionales significativas en nuestros pacientes que explicaran por qué unos se ceñían al techo de flujo (LFE) y otros no (tabla 1 y fig. 1) en situación de reposo.
Por otro lado, en la mayoría de los casos, de acuerdo con lo descrito con anterioridad en la literatura médica, la hiperventilación producida por el ejercicio se acompañó de un incremento de la LFE, y casi todos los pacientes presentaban LFE al nivel más alto de ejercicio estudiado7,13,29. La tan sólo moderada correlación existente entre la LFE en reposo y al 70% de la Wmáx traduce los cambios fisiológicos inducidos por el ejercicio: hiperventilación y cambios asociados de los volúmenes pulmonares por supuesto, pero también modificaciones posturales del cuello y la caja torácica, cambios en el calibre bronquial, en la distensibilidad pulmonar (p. ej., modificaciones en la perfusión pulmonar) o la posible aparición de fatiga de los músculos respiratorios relacionada con el ejercicio13,31. Con el esfuerzo, los pacientes globalmente desplazaron su VTE hacia la capacidad pulmonar total; sin embargo, una mayor HD se relacionó con un menor porcentaje de LFE. En otras palabras, los pacientes que utilizaron menos sus reservas de flujo espiratorio (mostrando menos LFE) usaron más las de volumen pulmonar (desarrollaron mayor HD; fig. 1). Los mecanismos que favorecen el desarrollo de HD actúan por 2 vías: a) dificultando la espiración (el incremento de la resistencia de las vías aéreas, la contracción persistente de la musculatura inspiratoria durante la espiración y la adaptación crónica de las fibras musculares del diafragma al trabajo a corta longitud), o b) acortando el tiempo espiratorio (se ha propuesto que un mecanismo reflejo finalizaría la espiración al alcanzarse el flujo espiratorio máximo, es decir, la LFE)2,30. Nuestros resultados apuntan a la intervención de la musculatura espiratoria como factor reductor de la HD en la EPOC grave a muy grave (véase más adelante).
Quizá el resultado más interesante y novedoso del presente estudio es la relación observada entre mayor HD durante ejercicio y menor resistencia de la musculatura espiratoria, ya que, aunque se sabe que en pacientes con EPOC los músculos abdominales tienen un papel importante y creciente durante el ejercicio (gran parte de la función inspiratoria del diafragma recae en los músculos accesorios y la musculatura abdominal se recluta en la espiración de manera progresiva y a menudo ya desde reposo), la disfunción muscular espiratoria ha sido descrita no hace mucho y aún no se han estudiado sus implicaciones15,31. Nuestro estudio indica que, dada la situación (o proximidad inmediata) de alcanzar la LFE, el hacerlo en mayor grado disminuiría la HD, y que la baja resistencia (aguante) de los músculos espiratorios puede estar implicada en el desarrollo de mayor HD. Apoya esta posibilidad el hecho de que PEthmáx guarde una relación inversa con el VTE y directa con la LFE, y que sea predictor independiente de un mayor VTE durante el ejercicio (junto con menores FEV1 y LFE), y también el hecho de que los 6 pacientes en que la LFE no aumentó durante el ejercicio mostraron menor PEthmáx. La situación durante el ejercicio es proclive al desarrollo de fatiga de estos músculos, que ya se ha demostrado en atletas sanos pero no se ha investigado hasta la fecha en pacientes con EPOC31, y que, en caso de producirse, comprometería su acción a favor del descenso del VTE al enfrentar el incremento de resistencia de las vías aéreas y la actividad tónica postinspiratoria del diafragma2. Aunque la LFE acota el incremento del flujo espiratorio, la disfunción de los músculos de la prensa abdominal podría limitar el flujo espiratorio antes de alcanzar su máximo durante el ejercicio y empeorar la situación mecánica de los músculos inspiratorios13,31. Diversos factores apoyan esa hipótesis: a) en pacientes con EPOC los músculos espiratorios, a pesar de ser reclutados incluso en reposo y estar teóricamente entrenados, a menudo muestran una fuerza y resistencia reducidas14, tal como observamos en nuestros pacientes; b) se han detectado signos electromiográficos de fatiga en pacientes con EPOC ante cargas espiratorias inferiores al 50% de su PEmáx14; c) durante el ejercicio, los grupos musculares activos (periféricos y respiratorios) compiten por el flujo sanguíneo y el aporte de oxígeno13,32, cosa que, dado el reducido consumo máximo de oxígeno y el alto coste metabólico del trabajo respiratorio típico de estos pacientes14, podría comprometer el aporte muscular de oxígeno; d) individuos sanos desarrollan fatiga prolongada de la musculatura abdominal tras mantener una ventilación entre el 55 y el 80% de la ventilación voluntaria máxima durante sólo 2 min13,33, superando todos nuestros pacientes el límite inferior de ese margen y 13 de ellos el superior mientras pedaleaban al 70% de su Wmáx, y e) tras un programa de rehabilitación con reentrenamiento al ejercicio de alta intensidad, pacientes con EPOC grave redujeron su VTE durante el ejercicio a expensas de reducir el volumen del compartimiento abdominal, lo que se explicaría por una mayor intervención de los músculos espiratorios34.
La asociación entre menor HD (y mayor LFE) y mejor función de los músculos espiratorios podría deberse alternativamente al entrenamiento inducido por el trabajo de oposición a una mayor LFE en pacientes con una mayor tolerancia a ésta. Esto indicaría que estos músculos son susceptibles de mejorar funcionalmente cuando se ejercitan de una manera adecuada, tal como Weiner et al han demostrado aplicando un programa de entrenamiento espiratorio específico a pacientes con EPOC. Asociados a la mejora funcional de estos músculos se han descrito un incremento de la distancia recorrida en la prueba de la marcha de 6 min35, mejora de la disnea y de la CVRS, así como la reducción de la relación FEV1/FVC16. Los presentes resultados, junto a los obtenidos con el entrenamiento específico espiratorio, indican que una mejora de la función de los músculos espiratorios podría beneficiar a los pacientes con EPOC avanzada que tienen reserva de flujo en parte del volumen corriente (porcentaje bajo o nulo de LFE), al menos en parte vía disminución de la HD. La correlación entre mayor resistencia de los músculos inspiratorios y menor VTE podría ser el resultado de la elongación de estos músculos al trabajar frente a un menor volumen pulmonar, o de un factor de confusión debido a la correlación coexistente entre función de los músculos inspiratorios y espiratorios2,34.
En pacientes con EPOC grave o muy grave parece más ventajoso “tolerar” un alto porcentaje de LFE que incrementar el volumen pulmonar operativo durante el ejercicio (tablas 3 y 4, y fig. 4). No ponemos en duda que la LFE tiene efectos negativos sobradamente descritos en la literatura médica: la presión espiratoria excesiva puede reducir el retorno venoso, incrementando la resistencia vascular pulmonar, y disminuir el gasto cardíaco13,31. Sin embargo, el balance entre éstos y los secundarios a la HD excesiva (principalmente la sobrecarga de la musculatura inspiratoria) parece dar mayor peso a la última. En nuestros pacientes no encontramos correlación entre el porcentaje de LFE en reposo y las variables clínicas. Eltayara et al6, en cambio, observaron asociación entre la LFE en reposo y la disnea, pero en un grupo de pacientes con un gran margen de obstrucción, entre ellos algunos con un FEV1 del 80% del valor de referencia (véase fig. 3 de Eltayara et al6). Al igual que estos autores, creemos que la traducción clínica de la LFE está mediada fundamentalmente por la HD3,4,7,36, de la cual la LFE actúa a modo de marcador en una población con un amplio margen de grados de obstrucción, como la estudiada por Eltayara et al6, pero no en nuestra muestra seleccionada de pacientes con una intensa obstrucción, en su mayoría con LFE y con similar grado de hiperinflación en reposo. La percepción de la disnea influye en la capacidad de esfuerzo y la CVRS, y se correlaciona de manera directa con el grado de HD en pacientes con EPOC27,37. De acuerdo con esto, en nuestros pacientes el mayor VTE durante el ejercicio se asoció a una mayor puntuación en la escala MRC, y una mayor LFE durante el ejercicio se asoció a mejor tolerancia al esfuerzo y a un menor deterioro en la CVRS (dominio de actividad del SGRQ).
En cuanto a las limitaciones del estudio, cabe mencionar que el número de pacientes incluidos fue probablemente insuficiente para mostrar diferencias entre aquéllos con y sin LFE en reposo (en especial este último grupo tuvo un tamaño reducido). Las tendencias observadas en la comparación entre grupos, que alcanzaron la significación en el área de impacto del SGRQ, apoyarían, de confirmarse en un estudio más amplio, que los pacientes con EPOC muy evolucionada y con mayor LFE en reposo presentan mejor situación clínica (menor disnea, mayor capacidad de esfuerzo y mejor calidad de vida) y una función muscular respiratoria más conservada, y podría conjeturarse que esta última tenga un papel causal, vía una menor HD mediada por la mejor situación de los músculos espiratorios, a la luz de nuestros resultados.
Durante el ejercicio se pueden producir cambios en el calibre bronquial que den lugar a broncodilatación o broncoconstricción y que modifiquen el techo de flujos máximos. No repetimos la espirometría al final del ejercicio para evaluar estos cambios, pero la técnica utilizada para medir la LFA (aplicación de NEP) no se ve afectada por ellos23, ya que se basa en la comparación de una curva flujo-volumen (en la que se aplica la presión negativa durante la espiración) con la del ciclo respiratorio inmediatamente anterior, siendo el escenario fisiológico esencialmente idéntico entre ambos, incluso durante la actividad física, con excepción del gradiente de presión externa que añadimos a la inspiratoria generada por el propio sujeto5–7. La técnica de NEP, validada mediante medición de presión transpulmonar5, no requiere maniobras forzadas por parte del paciente, evita los errores debidos a la compresión del gas torácico y las diferencias en la historia tiempo-volumen de los ciclos respiratorios, y puede utilizarse en distintas posiciones y durante el ejercicio5,7,23. Dado que la NEP puede detectar falsos positivos secundarios al colapso de una vía aérea superior muy distensible38, se tomaron varias precauciones para evitar este problema: a) exclusión de los pacientes con síntomas y/u oximetría indicativos de síndrome de apnea-hipopnea del sueño; b) aplicación de una NEP de sólo 3 cmH2O (suficiente para detectar incremento del flujo, en ausencia de LFE, con un aumento mínimo de la resistencia de la vía aérea superior, de acuerdo con Tantucci et al39, y corroborado en ensayos previos con personas sanas y enfermas en nuestro laboratorio, los cuales han demostrado que una NEP de sólo 2cm produce incrementos detectables y mensurables en el flujo espiratorio en ausencia de LFE en reposo en personas sanas y enfermas; datos no publicados), y c) un observador con experiencia controló visualmente las maniobras durante su realización y descartó aquéllas con artefactos. Otras limitaciones de la técnica, ya descritas en la literatura médica, son la variabilidad respiración a respiración del valor obtenido40, que se abordó obteniendo un promedio de varias maniobras (mínimo de 3) que resultara más representativo de la situación real, y la imposibilidad de detectar LFE en la fase inicial de la espiración, por lo que su valor máximo es de aproximadamente el 70%VT, aunque no creemos que este hecho afecte a la validez de nuestros resultados.
Desde un punto de vista técnico, la realización de maniobras repetidas de CI es un método validado para medir la HD durante el ejercicio, aunque el hecho de que sea dependiente del esfuerzo constituye una posible fuente de error, que se intentó evitar con diversas precauciones, como se ha descrito en el apartado “Pacientes y métodos”.
En conclusión, en pacientes con EPOC grave o muy grave la LFE es un hallazgo común en reposo, y durante el ejercicio se incrementa y muestra una relación inversa con la HD. Los grados de LFE e HD durante el ejercicio son sumamente variables, lo que indica la existencia de distintos comportamientos en estos pacientes, resultado de la combinación del uso de la reserva de flujo o de volumen pulmonar para incrementar la ventilación. La estrategia consistente en reducir la HD e incrementar la LFE parece clínicamente más ventajosa, pues se asocia a menor disnea, mejor tolerancia al ejercicio y superior CVRS. La mayor resistencia de los músculos espiratorios se asocia con esta estrategia, lo que invita a pensar en un posible papel de la disfunción muscular espiratoria en el desarrollo de HD, hipótesis que debe verificarse. De ser así, las intervenciones destinadas a potenciar la función de los músculos de la prensa abdominal, como la incorporación del entrenamiento específico espiratorio a los programas de rehabilitación respiratoria, podrían dar lugar a una mejoría de los síntomas y de la CVRS, sobre todo en los pacientes con obstrucción grave que no presenten LFE.
FinanciaciónEstudio financiado en parte por becas FUCAP, SEPAR, FIS (98/1143), ISCIII (RTIC C03/11) y de la Comisión Europea (BMH4-CT98-3406).
Este estudio ha sido posible gracias a la colaboración inestimable de Fátima Morante, Ingrid Solanes, Manuel Brufal, Jordi Giner, Esperança Codina, Teresa Freixas, Nuria Calaf, Mercedes González, Rosa María Miralda, Montserrat Torrejón, Aparicia Ramos y Juanjo Cuesta.
Resultados preliminares presentados en el congreso anual de la SEPAR celebrado en Madrid en 2004.