Las técnicas moleculares han permitido un mejor conocimiento de la etiología de las infecciones respiratorias infantiles. El objetivo del estudio fue analizar la coinfección viral y su relación con la gravedad clínica.
MétodosSe estudió a pacientes pediátricos hospitalizados con diagnóstico clínico de infección respiratoria durante el periodo comprendido entre 2009 y 2010. Se recogieron datos clínicos, epidemiológicos, duración de la hospitalización, necesidad de oxigenoterapia, coinfección bacteriana y necesidad de ventilación mecánica. Etiología estudiada con técnica PCR múltiple y microarrays de baja densidad para 19 virus.
ResultadosUn total de 385 pacientes presentaron resultados positivos, 44,94% menores de 12 meses. Los virus más detectados fueron: VRS-B: 139, rhinovirus: 114, VRS-A: 111, influenza A H1N1-2009: 93 y bocavirus: 77. Se detectó coinfección en el 61,81%, un 36,36% con 2 virus, 16,10% con 3 y 9,35% con 4 o más. La coinfección fue superior en 2009 con 69,79 frente 53,88% en 2010. Rhinovirus/VRS-B en 10 ocasiones y VRS-A/VRS-B en 5 fueron las coinfecciones más detectadas. Menor hospitalización a mayor número de virus detectados (p<0,001). Necesitaron oxigenoterapia el 26,75% (en 55,34% se aisló un virus), objetivando a mayor número de virus menor necesidad de oxígeno (p<0,001). Precisaron ventilación mecánica 9 casos, 4 de ellos con coinfección bacteriana y 5 con coinfección vírica (p=0,69).
ConclusionesObjetivamos una relación inversamente proporcional entre número de virus detectados en aspirado nasofaríngeo, necesidad de oxigenoterapia y días de hospitalización. Se necesitan más estudios epidemiológicos y mejoría en las técnicas de detección cuantitativa para definir el papel de las coinfecciones víricas en la enfermedad respiratoria y su correlación con la gravedad clínica.
The introduction of molecular techniques has enabled better understanding of the etiology of respiratory tract infections in children. The objective of the study was to analyze viral coinfection and its relationship to clinical severity.
MethodsHospitalized pediatric patients with a clinical diagnosis of respiratory infection were studied during the period between 2009-2010. Clinical and epidemiological data, duration of hospitalization, need for oxygen therapy, bacterial coinfection and need for mechanical ventilation were collected. Etiology was studied by multiplex PCR and low-density microarrays for 19 viruses.
ResultsA total of 385 patients were positive, 44.94% under 12 months. The most frequently detected viruses were RSV-B: 139, rhinovirus: 114, RSV-A: 111, influenza A H1N1-2009: 93 and bocavirus: 77. Coinfection was detected in 61.81%, 36.36% with 2 viruses, 16.10% and 9.35% with 3 to 4 or more. Coinfection was higher in 2009 with 69.79 vs. 53.88% in 2010. Rhinovirus/RSV-B on 10 times and RSV-A/RSV-B on 5 times were the most detected coinfections. Hospitalization decreased with greater number of viruses (P<0,001). Oxygen therapy was required by 26.75% (one virus was detected in 55.34% of cases). A larger number of viruses resulted in less need for oxygen (P<0,001). Ten cases required mechanical ventilation, 4 patients with bacterial coinfection and 5 with viral coinfection (P=0,69).
ConclusionsAn inverse relationship was found between the number of viruses detected in nasopharyngeal aspirate, the need for oxygen therapy and hospitalization days. More epidemiological studies and improved quantitative detection techniques are needed to define the role of viral coinfections in respiratory disease and its correlation with the clinical severity.
La infección vírica respiratoria es una causa de elevada morbimortalidad durante la infancia. Algo más de la tercera parte de los niños en edad preescolar desarrollan infecciones de las vías respiratorias bajas durante el primer año de vida. La necesidad de hospitalización en estos casos se sitúa entre el 1 y el 2% de los pacientes1,2.
El agente etiológico no siempre es conocido. Los niños con infecciones respiratorias habitualmente son seguidos de forma ambulatoria, sin estudio de la etiología de la misma y, cuando son hospitalizados, las técnicas de estudio que se utilizan habitualmente carecen de sensibilidad adecuada3.
En los últimos años ha aumentado la experiencia y el conocimiento del papel de las coinfecciones virales en las infecciones respiratorias gracias a la incorporación de las técnicas moleculares4–6. En la actualidad los datos clínicos existentes sobre las coinfecciones, tanto por lo que refiere al número de virus implicados como a la gravedad asociada, es variable y, a veces, discrepante. Probablemente estas diferencias estén relacionadas con los diferentes agentes etiológicos implicados según la localización geográfica y con los métodos de detección empleados.
El objetivo de nuestro trabajo fue analizar la etiología vírica de las infecciones respiratorias, así como de la realidad clínica de la coinfección, y su posible relación con la gravedad clínica a través de nuestra experiencia en los casos hospitalizados en un hospital general de Barcelona, con servicio de pediatría de segundo nivel, aplicando una técnica de polimerasa chain reaction (PCR) múltiple y detección mediante microarrays de baja densidad.
Pacientes, materiales y métodosPacientesSe estudió prospectivamente a los pacientes pediátricos, con edades comprendidas entre 7 días y 15 años, que se hospitalizaron por infección respiratoria durante el período comprendido entre el 1 de febrero del 2009 y el 31 de diciembre del 2010 en el Servicio de Pediatría del Hospital del Mar de Barcelona. El criterio básico de inclusión era un diagnóstico inicial de: a) infección de las vías respiratorias (rinofaringitis, laringitis, traqueobronquitis o neumonía), con orientación clínica de probable infección vírica; b) síndrome gripal; c) sospecha de tos ferina; d) neumonías con orientación clínica bacteriana o empiemas, con mala evolución durante el ingreso con sospecha de probable coinfección vírica.
Se recogieron datos personales, epidemiológicos, motivo del ingreso así como su curso clínico, duración de la hospitalización, necesidades de oxígeno en los casos con saturaciones ≤ 92%, y necesidad de ingreso en Unidad de Cuidados Intensivos Pediátricos (UCIP) para ventilación mecánica.
Se estudiaron los casos estratificados por grupos de edad (menores de 12 meses, entre 1 y 3 años, entre 3 y 5 años, y mayores 5 años), la orientación diagnóstica en el momento del ingreso, los días de hospitalización agrupados en menor a 4 días, entre 5-10 días y superior a 10 días, necesidad de oxigenoterapia, necesidad de traslado a UCIP para ventilación mecánica, número de virus detectados y la presencia de coinfección bacteriana.
Muestras para estudio virológicoDe cada uno de ellos se recogió un aspirado nasofaríngeo en las primeras 12 h del ingreso. En los ingresados con sospecha clínica de neumonía bacteriana, en el momento en que existía una mala evolución con sospecha de que pudiera atribuirse a una coinfección vírico-bacteriana y no a la propia de una mala respuesta al tratamiento o a la virulencia del agente etiológico, se recogía una muestra de aspirado nasofaríngeo. La técnica se realizaba en el mismo día de la extracción, excepto los fines de semana. Las muestras se conservaban a una temperatura de 2-8°C hasta su realización.
Extracción de los ácidos nucleicosLa extracción de los ácidos nucleicos (ARN/ADN) se llevó a cabo mediante MagnaPure LC de Roche diagnostics.
Amplificación y detecciónSe utilizó el kit CLART®PneumoVi, de Laboratorios Genómica, Madrid, España, capaz de detectar y caracterizar la presencia de los 19 tipos y subtipos más frecuentes de virus humanos que causan infecciones respiratorias. Los virus analizados son: adenovirus; bocavirus; coronavirus; enterovirus (echovirus); influenza virus A (subtipos H3N2 humano, H1N1 humano, B, C y H1N1/2009); metapneumovirus (subtipos A y B); parainfluenza virus 1, 2, 3, y 4 (subtipos A y B); rhinovirus; virus respiratorio sincitial tipo A (VRS-A); virus respiratorio sincitial tipo B (VRS-B).
La detección de los virus se lleva a cabo mediante una técnica de reacción en cadena de polimerasa (múltiple) precedida de una transcripción inversa del ARN viral (RT-PCR) para la amplificación de un fragmento específico del genoma vírico de entre 120 y 330 pb. La visualización del amplificado se realiza en la plataforma tecnológica basada en microarrays de baja densidad: CLART® (Clinical Array Technology).
Cada tubo de amplificado lleva un control interno como control de amplificación.
En el año 2009 el sistema no incluía la detección del virus influenza A H1N1/2009. En el 2010 el sistema incluyó su detección. La detección de este virus, hasta que no fue incorporada en la plataforma, se llevó a cabo mediante PCR a tiempo real (RT-PCR) a través de la detección de los genes M2 y HA1, con el kit comercializado por Roche.
Análisis estadísticoLos datos obtenidos fueron almacenados en una base de datos con soporte en el programa Excel y el análisis estadístico se realizó con el programa SPSS. En primer lugar se llevó a cabo la estadística descriptiva univariada. Las variables cualitativas se presentan mediante la distribución de frecuencias de los porcentajes de cada categoría. En la fase de estadística analítica, se analizó si el número de virus detectados estaba relacionado con los días de hospitalización, la edad y la necesidad de oxigenoterapia. La asociación entre estos factores se ha investigado mediante pruebas de contraste de hipótesis, con comparación de proporciones mediante la prueba Chi-cuadrado de Pearson. Resultados con p<0,05 se consideraron significativos.
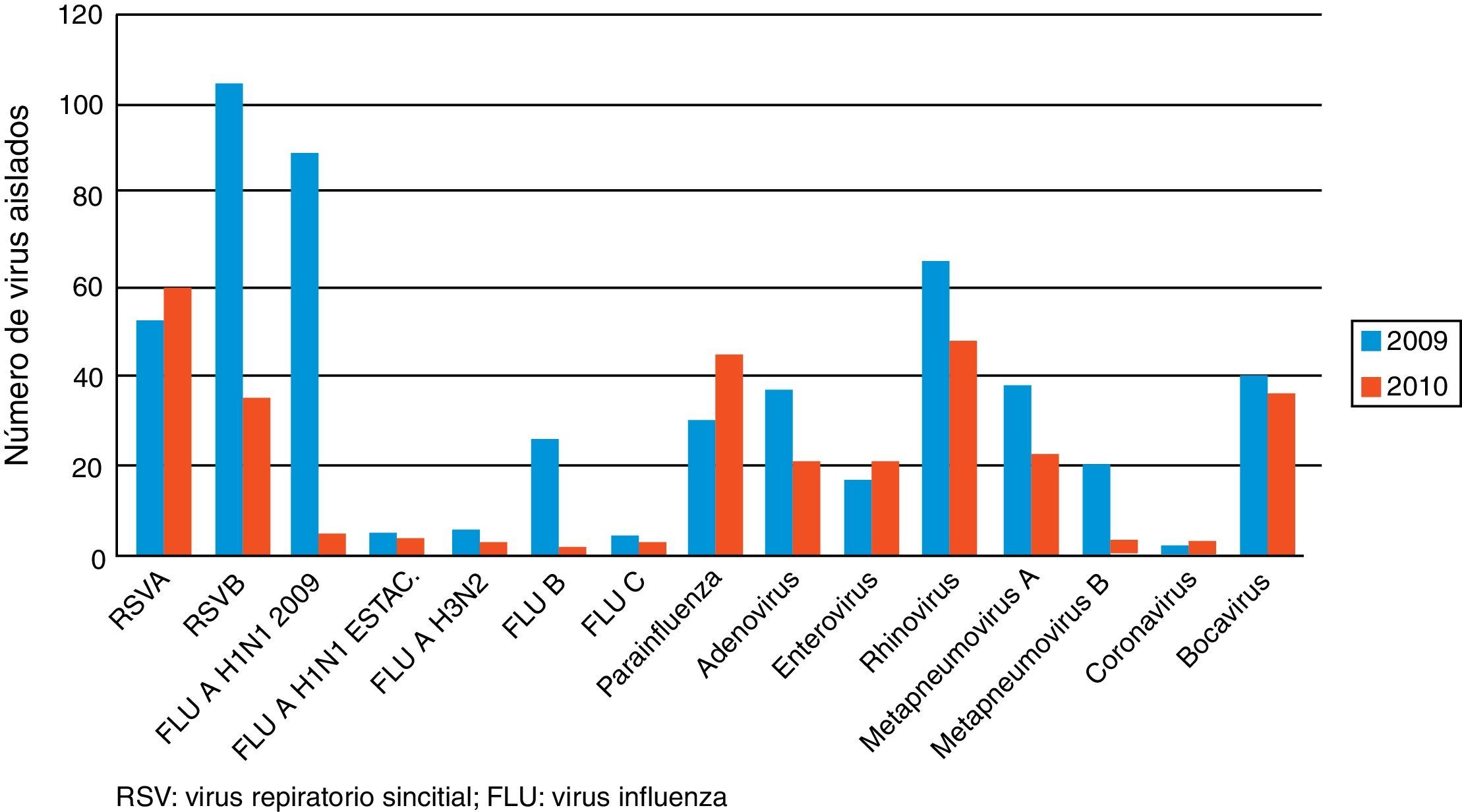
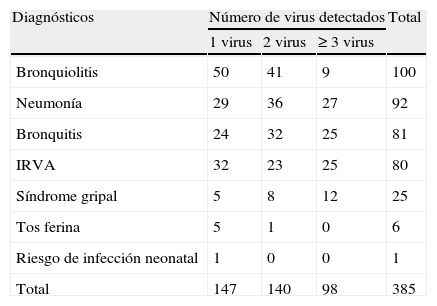
ResultadosSe analizaron 463 muestras de pacientes en edad pediátrica ingresados en el Servicio de Pediatría del Hospital del Mar de Barcelona por infecciones de vías respiratorias adquiridas en la comunidad con resultado positivo en 385 muestras (83,15%). La distribución etaria fue: menores de 12 meses 173 (44,94%), de 12 meses a 3 años 143 (37,14%), de 3 años a 5 años 53 (13,77%) y mayores de 5 años 16 (4,15%). El 44,94% de los casos se sitúan en la franja de edad menor de 12 meses. En ningún paciente existían factores de riesgo para enfermedades respiratorias. Los diagnósticos clínicos de los casos positivos correspondían a 100 bronquiolitis, 92 neumonías, 81 bronquitis, 80 infecciones respiratorias de vías altas, 25 síndromes gripales, 6 tos ferinas y un recién nacido con riesgo de infección tal como se refleja en la tabla 1.
Relación entre el número de virus detectados y los diagnósticos observados
| Diagnósticos | Número de virus detectados | Total | ||
| 1 virus | 2 virus | ≥ 3 virus | ||
| Bronquiolitis | 50 | 41 | 9 | 100 |
| Neumonía | 29 | 36 | 27 | 92 |
| Bronquitis | 24 | 32 | 25 | 81 |
| IRVA | 32 | 23 | 25 | 80 |
| Síndrome gripal | 5 | 8 | 12 | 25 |
| Tos ferina | 5 | 1 | 0 | 6 |
| Riesgo de infección neonatal | 1 | 0 | 0 | 1 |
| Total | 147 | 140 | 98 | 385 |
IRVA: infección respiratoria de vías altas.
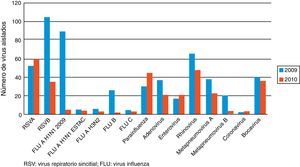
Los virus detectados se muestran en la figura 1. Los 5 virus más destacados, en la suma de los 2 períodos estudiados, fueron VRS-B 139, rhinovirus 114, VRS-A 111, virus influenza serotipo A H1N1-2009 93 y bocavirus 77. Los porcentajes de codetecciones de cada período fueron: a) en el 2009, el 69,79% de las infecciones estaban causadas por más de un agente vírico (134 de 192 infecciones detectadas); b) en el 2010 fueron el 53,88% (104 de 193 infecciones detectadas). Las coinfecciones más frecuentes fueron rhinovirus+VRS-B en 10 ocasiones y VRS-A+VRS-B en 5.
La coinfección se presentó en el 61,81% de los estudiados con resultado positivo donde en el 36,36% se detectaron 2 virus, en el 16,10% fueron 3 virus y en el 9,35% una cifra igual o mayor a 4 virus.
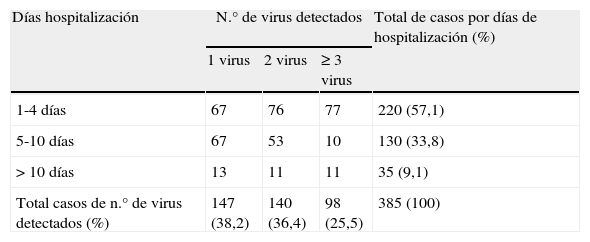
Objetivamos una menor hospitalización a mayor número de virus detectados (p<0,001) como se refleja en la tabla 2 y siguiendo una asociación lineal.
Correlación entre los días de hospitalización y la detección de virus respiratorios
| Días hospitalización | N.° de virus detectados | Total de casos por días de hospitalización (%) | ||
| 1 virus | 2 virus | ≥ 3 virus | ||
| 1-4 días | 67 | 76 | 77 | 220 (57,1) |
| 5-10 días | 67 | 53 | 10 | 130 (33,8) |
| > 10 días | 13 | 11 | 11 | 35 (9,1) |
| Total casos de n.° de virus detectados (%) | 147 (38,2) | 140 (36,4) | 98 (25,5) | 385 (100) |
p<0,001.
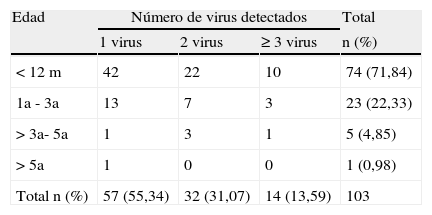
Los 103 casos que necesitaron oxigenoterapia (saturaciones basales ≤ 92%) se pueden observar en la tabla 3. Al correlacionar estos datos se observó como a menor edad aumenta el número de casos que precisan oxigenoterapia, siendo estadísticamente significativo (p<0,001) y a mayor número de virus detectados menor necesidad de oxigenoterapia (p<0,001).
Correlación entre la edad y el número de virus detectados en los pacientes que precisaron oxigenoterapia
| Edad | Número de virus detectados | Total | ||
| 1 virus | 2 virus | ≥ 3 virus | n (%) | |
| < 12m | 42 | 22 | 10 | 74 (71,84) |
| 1a - 3a | 13 | 7 | 3 | 23 (22,33) |
| > 3a- 5a | 1 | 3 | 1 | 5 (4,85) |
| > 5a | 1 | 0 | 0 | 1 (0,98) |
| Total n (%) | 57 (55,34) | 32 (31,07) | 14 (13,59) | 103 |
p<0,001.
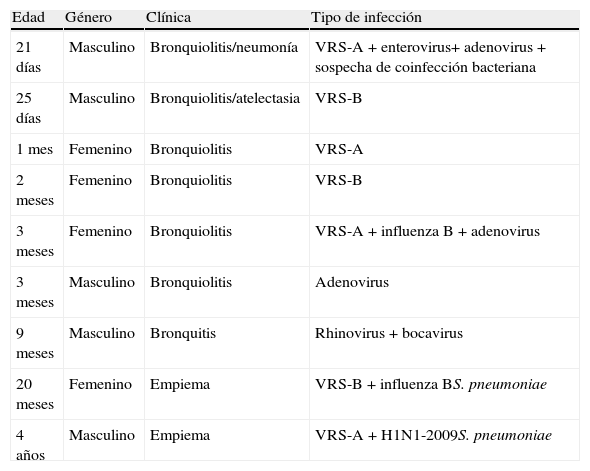
Precisaron ingreso en UCIP para ventilación mecánica 9 casos. En la tabla 4 se describe la edad, la forma clínica de presentación, los virus detectados y su diagnóstico. El agente etiológico dominante en los mismos fue VRS. No se observaron diferencias estadísticamente significativas al correlacionar la coinfección vírica y la necesidad de UCIP para ventilación mecánica (p=0,69).
Características de los pacientes ingresados en la Unidad de Cuidados Intensivos Pediátricos
| Edad | Género | Clínica | Tipo de infección |
| 21 días | Masculino | Bronquiolitis/neumonía | VRS-A+enterovirus+ adenovirus+sospecha de coinfección bacteriana |
| 25 días | Masculino | Bronquiolitis/atelectasia | VRS-B |
| 1 mes | Femenino | Bronquiolitis | VRS-A |
| 2 meses | Femenino | Bronquiolitis | VRS-B |
| 3 meses | Femenino | Bronquiolitis | VRS-A+influenza B+adenovirus |
| 3 meses | Masculino | Bronquiolitis | Adenovirus |
| 9 meses | Masculino | Bronquitis | Rhinovirus+bocavirus |
| 20 meses | Femenino | Empiema | VRS-B+influenza BS. pneumoniae |
| 4 años | Masculino | Empiema | VRS-A+H1N1-2009S. pneumoniae |
La sospecha clínica de coinfección bacteriana se estableció en 37 casos (8,50%) y se fundamentó por la clínica y los valores de los reactantes de fase aguda aunque solo en 2 casos se obtuvo confirmación por hemocultivo o PCR positiva a Streptococcus pneumoniae en el líquido pleural. En 20 de ellos se detectó un virus y en 14 de los casos, 2 virus. La duración de la hospitalización fue entre 1 y 4 días en 27 pacientes y entre 5 y 10 días en 10 pacientes. En los 8 casos diagnosticados de neumonía atípica mediante serología, se detectó coinfección vírica por un solo virus en 5 de ellos.
DiscusiónEl primer aspecto a resaltar de los resultados es la elevada positividad entre población sin factores de riesgo (83,15% de las muestras estudiadas), y, asimismo, de la elevada tasa de coinfección hallada (61,81%), especialmente en el primer año estudiado (69,79%). En la literatura, el tanto por ciento de coinfección oscila entre 8 y el 76% según las series7–16. En cuanto a la gravedad de los casos estudiados, se debe resaltar que un mayor número de virus detectados no es sinónimo de mayor gravedad. Según nuestros resultados, existe una relación inversamente proporcional entre el número de virus detectados y la necesidad de oxigenoterapia y días de hospitalización, siendo estadísticamente significativa (p<0,001), aunque en los escasos 9 casos que precisaron ingreso en UCIP se registró un mayor dominio de casos con coinfección, pero sin significación estadística.
Existen estudios realizados en los que no se encontraron diferencias clínicas entre los pacientes con infecciones respiratorias causadas por un único agente y las causadas por múltiples virus en las muestras de aspirado nasofaríngeo estudiadas entre los niños hospitalizados8,11,13,17–23. Cabe destacar el estudio realizado en Sao Paulo por Camargo22, durante la epidemia de virus influenza H1N1 del 2009, donde el 21,9% de los casos presentaron coinfección sin que se asociara a una mayor morbimortalidad. Por el contrario también existen estudios que muestran que la coinfección es un factor de riesgo de peor evolución14,24–28. De ellos destacamos un estudio realizado en Viena, por Aberle et al.14, entre 2000 y 2004: se observó que el cuadro obstructivo era más grave si en la coinfección estaba implicado el VRS y se aumentaban los días de estancia media hospitalaria en el caso de que el rhinovirus fuera el implicado y otro estudio realizado por Grensill et al.26 mostró que cuando la coinfección era entre VRS y metapneumovirus, la evolución era más grave. Asimismo, en el estudio de Richard et al.28 que relacionaba la coinfección con necesidad de ingreso en UCIP, llegaron a la conclusión de que la presencia de 2 o más virus implicados aumentaba la probabilidad de ingreso en UCIP en 2,7 veces. En cambio, en otro estudio realizado por Ghani et al.29, en pacientes ingresados en UCIP, solo si existía una coinfección bacteriana implicaba una mayor estancia hospitalaria, sin mayor mortalidad.
También debemos considerar que la presencia prolongada de fragmentos virales, entre 5 y 6 semanas después del inicio de la sintomatología14 podría explicar la detección de más de un virus, sin que realmente tengan un papel en la patogenicidad del proceso30. La epidemiología puede ayudar a establecer relaciones, pero la utilización de técnicas cuantitativas ayudaría mucho más a la interpretación de estos resultados discrepantes como sucede con la atribución o no de mayor gravedad a las coinfecciones.
Una limitación importante de nuestro trabajo, en cuanto al papel de la coinfección en las infecciones respiratorias de vías altas, es el escaso número de este tipo de infecciones estudiadas, si se tiene en cuenta la frecuencia con que se presentan en la práctica habitual pediátrica. La no necesidad de hospitalización en la gran mayoría de las mismas limita el conocimiento de la realidad para poder extrapolar nuestros datos a la población general y un último aspecto, hasta ahora desconocido, sería el papel que a largo plazo pueden tener estas coinfecciones en el aparato respiratorio con el desarrollo de enfermedad pulmonar crónica.
ConclusionesAunque en nuestro estudio objetivamos una relación inversamente proporcional entre el número de virus detectados en aspirado nasofaríngeo, la necesidad de oxigenoterapia y los días de hospitalización, existen grandes discrepancias respecto a los datos de otros estudios publicados en la literatura, por lo que se necesitan más estudios epidemiológicos y mejoría en las técnicas de detección cuantitativa para definir el papel de las coinfecciones víricas en la enfermedad respiratoria y su correlación con la gravedad clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.