El uso de ventilación no invasiva (VNI) en pacientes sin EPOC con neumonía es motivo de controversia, debido a la elevada tasa de fracasos y a los efectos potencialmente nocivos de dicho fracaso. La finalidad de este estudio fue evaluar la evolución de los pacientes en función de cuál había sido el primer tipo de soporte ventilatorio aplicado, VNI o ventilación mecánica invasiva (VM), e identificar factores de predicción del fracaso de la VNI.
MétodosEstudio de una cohorte histórica de 159 pacientes sin EPOC con neumonía ingresados en la UCI que recibieron soporte ventilatorio. Los pacientes se clasificaron en dos grupos, VM invasiva y VNI. Se efectuaron análisis univariantes y multivariantes de los datos demográficos y clínicos. El análisis de mortalidad se ajustó por índice de propensión a ser conectado a VM invasiva como tratamiento inicial.
ResultadosCiento trece pacientes fueron conectados a VM invasiva como tratamiento ventilatorio inicial y 46 a VNI, 27 de los cuales precisaron intubación. La mortalidad hospitalaria fue del 35, 37 y 56%, respectivamente, y no se observaron diferencias significativas entre grupos. En el análisis ajustado a la propensión (expresada mediante (OR [IC 95%]), la mortalidad hospitalaria se asoció con la edad (1,05 [1,02 - 1,08]), la puntuación SAPS3 (1,03 [1,00 - 1,07]), la inmunosupresión (2,52 [1,02 - 6,27]) y el fracaso de la VNI, en comparación con la VM invasiva de primera línea (4,3 [1,33 - 13,94]). En comparación con la VM invasiva, el fracaso de la VNI retrasó la intubación (p=0,004), prolongó la duración de la VM invasiva (p=0,007) y la estancia en la UCI (p=0,001). El fracaso de la VNI se asoció con la necesidad de recibir fármacos vasoactivos (OR 7,8 [IC 95%, 1,8 - 33,2], p=0,006).
ConclusionesEn pacientes sin EPOC con neumonía, la VNI como tratamiento ventilatorio inicial no se asoció con mejor evolución, en comparación con la VM invasiva de primera línea. El fracaso de la VNI se relacionó con duraciones más prolongadas de la MV y la estancia hospitalaria, y con mayor mortalidad hospitalaria. El uso de fármacos vasoactivos fue predictivo del fracaso de la VNI.
The use of noninvasive ventilation (NIV) in non-COPD patients with pneumonia is controversial due to its high rate of failure and the potentially harmful effects when NIV fails. The purpose of the study was to evaluate outcomes of the first ventilatory treatment applied, NIV or invasive mechanical ventilation (MV), and to identify predictors of NIV failure.
MethodsHistorical cohort study of 159 non-COPD patients with pneumonia admitted to the ICU with ventilatory support. Subjects were divided into 2 groups: invasive MV or NIV. Univariate and multivariate analyses with demographic and clinical data were performed. Analysis of mortality was adjusted for the propensity of receiving first-line invasive MV.
ResultsOne hundred and thirteen subjects received first-line invasive MV and 46 received first-line NIV, of which 27 needed intubation. Hospital mortality was 35, 37 and 56%, respectively, with no significant differences among groups. In the propensity-adjusted analysis (expressed as OR [95% CI]), hospital mortality was associated with age (1.05 [1.02-1.08]), SAPS3 (1.03 [1.00-1.07]), immunosuppression (2.52 [1.02-6.27]) and NIV failure compared to first-line invasive MV (4.3 [1.33-13.94]). Compared with invasive MV, NIV failure delayed intubation (p=.004), and prolonged the length of invasive MV (p=.007) and ICU stay (p=.001). NIV failure was associated with need for vasoactive drugs (OR 7.8 [95% CI, 1.8-33.2], p=.006).
ConclusionsIn non-COPD subjects with pneumonia, first-line NIV was not associated with better outcome compared with first-line invasive MV. NIV failure was associated with longer duration of MV and hospital stay, and with increased hospital mortality. The use of vasoactive drugs predicted NIV failure.
El uso de ventilación mecánica no invasiva (VNI) en el tratamiento de pacientes críticos ha aumentado claramente desde finales del siglo XX1. La VNI forma parte de las normas asistenciales de los pacientes con exacerbación de su EPOC, especialmente cuando es de tipo hipercápnico2–4.
De forma similar, se han descrito efectos favorables de la VNI en pacientes con EPOC y neumonía5–8, pero su utilidad en pacientes sin EPOC con neumonía grave sigue siendo motivo de controversia, debido al elevado porcentaje de fracasos de la VNI6,9. En este sentido, existe una cierta preocupación por los efectos de la VNI en la evolución de estos pacientes, ya que se ha descrito que no aporta efectos beneficiosos e incluso que empeora la evolución, especialmente cuando fracasa1,6,10–16 y, en particular, cuando retrasa la intubación8. Se han propuesto varias explicaciones que podrían justificar la mala evolución observada en pacientes que precisan intubación tras el fracaso de la VNI, tales como el retraso en la intubación8, el eventual elevado volumen corriente espirado durante la VNI17 o complicaciones de la propia intubación18. Asimismo, pacientes con neumonía grave suelen presentar comorbilidades, como EPOC, insuficiencia cardíaca o inmunosupresión19,20 que pueden confundir en la evaluación de la eficacia de la VNI. A pesar de esto, la VNI se usa con frecuencia en servicios de urgencias y unidades de cuidados intensivos (UCI) para tratar la neumonía y con el objetivo de evitar la intubación21,22.
El objetivo principal de este estudio fue evaluar los efectos de la VNI, en comparación con la VM invasiva como tratamiento ventilatorio inicial, sobre la mortalidad hospitalaria en la práctica clínica real, en pacientes sin EPOC con neumonía que precisaban soporte ventilatorio. Los objetivos secundarios fueron evaluar los efectos de la VNI sobre la duración de la estancia e identificar factores capaces de predecir el fracaso de la VNI.
MétodosEntorno y población del estudioEn el estudio se incluyeron pacientes con diagnóstico principal de neumonía que habían sido ingresados consecutivamente en nuestra UCI desde marzo de 2002 hasta octubre de 2012. Los pacientes se identificaron a través de la base de datos de informes de la UCI. El equipo médico revisó los episodios seleccionados y confirmó que el diagnóstico de neumonía había sido el motivo del ingreso en UCI. La neumonía se definió por la presencia de infiltrados pulmonares en la radiografía de tórax en el momento del ingreso en la UCI y de síntomas (tos, esputo purulento, disnea o fiebre) y signos (crepitantes o recuento leucocitario superior a 12,0×109/l o inferior a 4,0×109/l) de infección de vías respiratorias23. El diagnóstico clínico de EPOC se determinó por la constatación de un cociente FEV1/FVC posbroncodilatación inferior a 0,70 o, alternativamente, por antecedentes de disnea, tos crónica y/o expectoración, y exposición a los factores de riesgo de la enfermedad del paciente24.
Los datos se recabaron consultando las historias clínicas electrónicas de los pacientes en las que el uso de dispositivos médicos y de perfusiones intravenosas se registra de manera automática (Optum Clinical Solutions®).
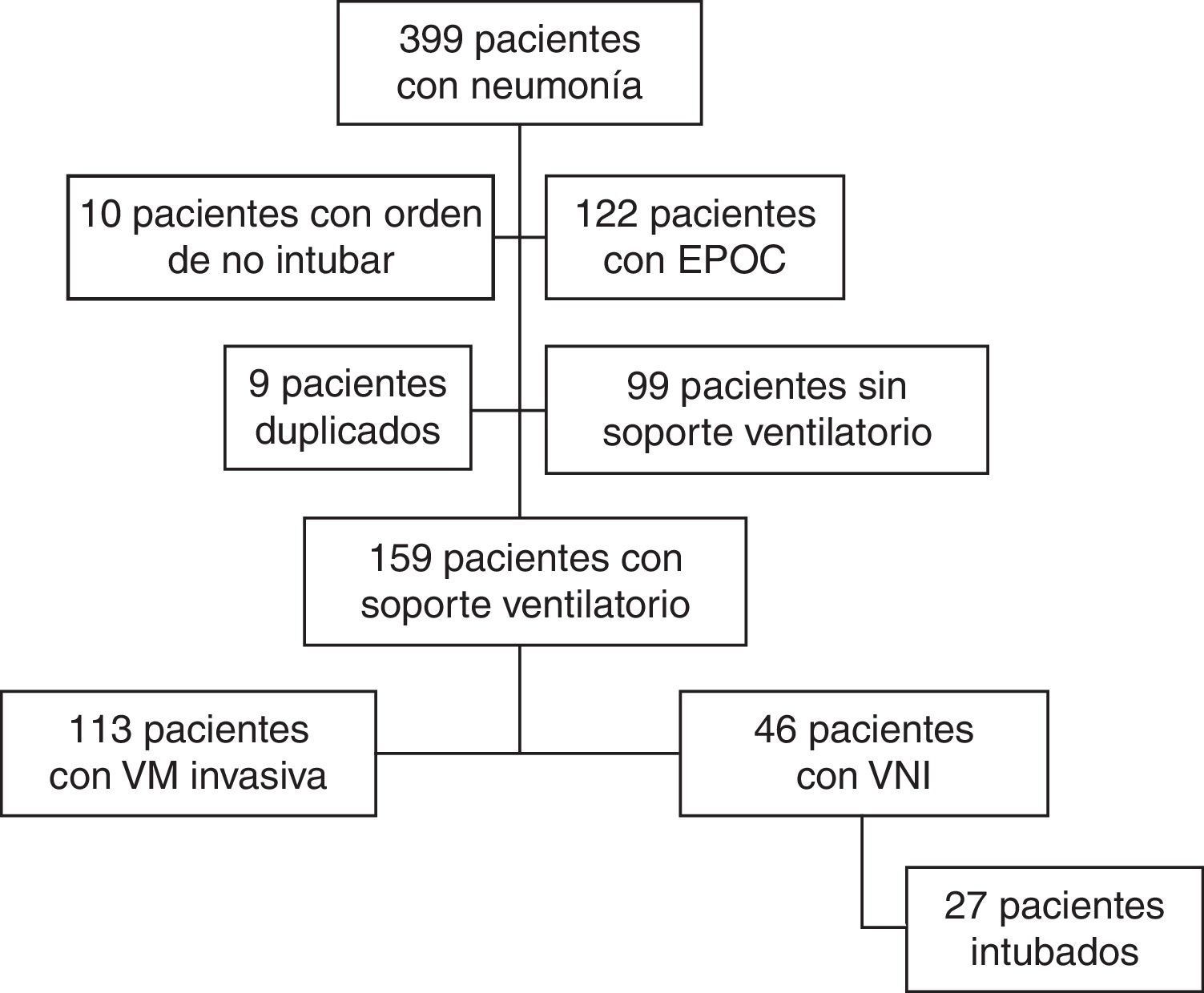
En el análisis no se incluyó a los pacientes con neumonía que no habían precisado asistencia respiratoria. A continuación, los pacientes incluidos se clasificaron en dos grupos, en función del primer tipo de asistencia aplicada: VM invasiva o VNI. Consideramos que la VNI había fracasado si el paciente había precisado intubación por la neumonía en algún momento. Se definió como fracaso precoz de la VNI la necesidad de intubación en las 48h siguientes a su inicio25.
Todos los pacientes recibieron tratamiento habitual según las normas asistenciales de nuestra unidad. Los médicos intensivistas del equipo decidieron la necesidad de asistencia respiratoria y el tipo de soporte a aplicar (invasivo o no invasivo) de forma no protocolizada. La interfaz utilizada en todos los episodios de ventilación no invasiva fue una máscara oronasal, y en todos los pacientes intubados se siguieron los protocolos de sedación-analgesia y de retirada del soporte ventilatorio.
Recogida de datosRecabamos las siguientes variables: edad, sexo, SAPS 326, fechas de ingreso y alta hospitalaria y de la UCI, necesidad y duración de la VNI o VM invasiva, muerte, orden de no intubar al ingreso en UCI, comorbilidades (EPOC, diabetes mellitus, insuficiencia cardíaca congestiva, insuficiencia renal crónica, insuficiencia hepática crónica, alcoholismo, inmunosupresión o infección por VIH), hospitalizaciones durante el año anterior, características fisiológicas en el momento del ingreso y antes de aplicar la ventilación (temperatura, presión arterial media, frecuencia respiratoria, frecuencia cardíaca y puntuación en la escala de coma de Glasgow [Glasgow Coma Scale –GCS–]), pruebas analíticas en el momento del ingreso (recuentos leucocitario y plaquetario, hemoglobina, lactato, urea, creatinina, bilirrubina y albúmina) y gasometría arterial (pH, PaCO2, PaO2) en el momento de la hospitalización, antes de la aplicación de la asistencia respiratoria. También recabamos otras variables, tales como el número de cuadrantes de la radiografía de tórax afectados en el momento del ingreso en la UCI, FiO2 inicial, origen de la neumonía (adquirida en la comunidad o nosocomial), uso de fármacos vasoactivos durante más de una hora en las primeras 24h, cultivos de esputo positivos o detección de antígeno urinario mediante inmunoanálisis enzimático de Streptococcus pneumonie o Legionella pneumophila, e idoneidad de la pauta antibiótica inicial, y se calculó la puntuación CURB6527.
Aspectos éticosEl comité de ética del Hospital Son Llàtzer (Palma de Mallorca, España) aprobó este estudio de una cohorte histórica en diciembre de 2014 y, debido a las características del diseño del estudio, eximió a los investigadores del requisito de obtener el consentimiento.
Análisis estadísticoPara las comparaciones de variables cualitativas o categóricas, expresadas mediante cifras y porcentajes, se utilizó la prueba de Chi-cuadrado. Las variables continuas se expresaron mediante la media y DE y, si con la prueba de Kolmogorov-Smirnov se determinaba que la distribución era normal, se compararon entre grupos mediante la prueba de la t de Student para datos independientes. En caso contrario, las variables continuas se expresaron mediante la mediana y el rango intercuartílico y se compararon mediante la prueba de la U de Mann-Whitney. Todos los análisis fueron bilaterales y los valores de p≤0,05 se consideraron significativos.
Se efectuaron análisis de Kaplan-Meier de la probabilidad acumulada de supervivencia o de la probabilidad de permanecer con ventilación mecánica en función de la asistencia respiratoria utilizada. Los grupos se compararon por medio de la prueba del orden logarítmico.
En el análisis multivariante, la asistencia respiratoria se introdujo como variable única con tres categorías distintas: la categoría de referencia fue la VM invasiva, con una oportunidad relativa ajustada a 1, que se comparó con el éxito y con el fracaso de la VNI.
Considerando que, en un estudio observacional, las asociaciones en las comparaciones no ajustadas podrían llevar a error, se efectuó un análisis del índice de propensión con el objetivo de reducir al mínimo el sesgo en las estimaciones del efecto del soporte ventilatorio inicial. Definimos el score de propensión de los pacientes tratados con VM invasiva o VNI como la probabilidad condicional de ser intubado en el primer abordaje en función de las covariables del sujeto, y la calculamos utilizando un modelo de regresión logística múltiple. La capacidad predictiva del modelo final se evaluó mediante la curva de características operativas del receptor (ROC), de la que se calculó el área bajo la curva (AUC).
En el análisis de regresión logística multivariante con eliminación secuencial de variables hacia atrás se incluyó el tipo de asistencia respiratoria y las variables que en el análisis univariante se asociaron con la mortalidad (pin<0,10 y pout<0,05). Una vez construido el modelo multivariante, el índice de propensión se añadió como variable independiente para calcular el riesgo ajustado de mortalidad hospitalaria. Los datos se procesaron con la versión 17.0 del programa informático SPSS.
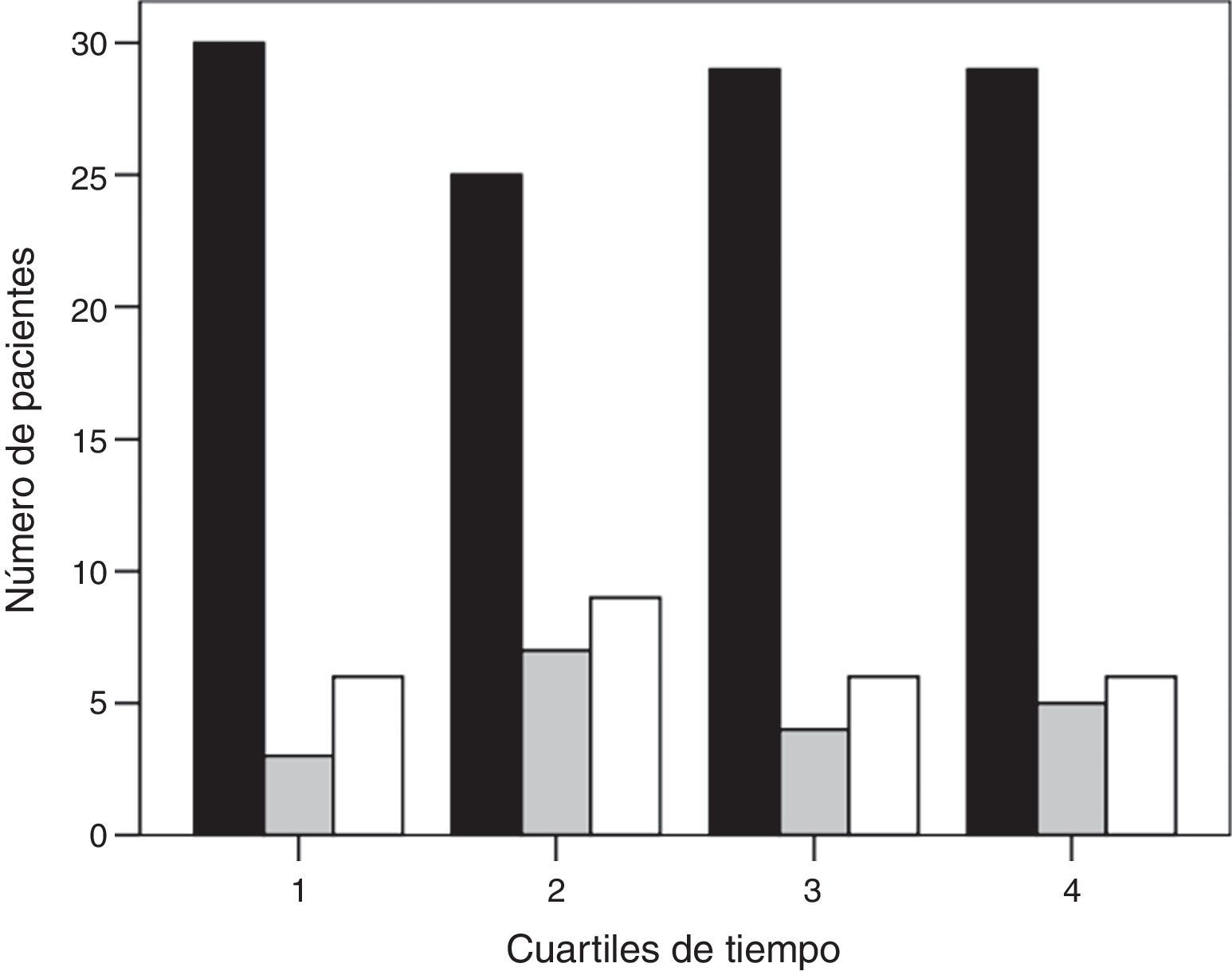
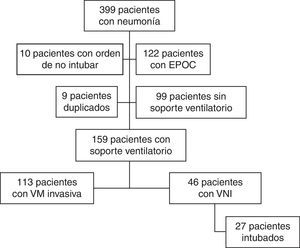
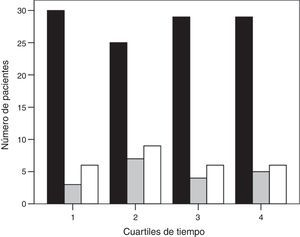
ResultadosDurante el periodo del estudio ingresaron en nuestra UCI 399 pacientes con neumonía. En la figura 1 se presenta el diagrama de flujo de estos pacientes. En el estudio participaron 159, de los cuales 113 (71%) fueron conectados a VM invasiva y 46 (29%) a VNI como primera asistencia respiratoria. La VNI fracasó en 27 de estos 46 pacientes (59%) que precisaron intubación. En el Anexo 1 se muestra el histograma del soporte ventilatorio aplicado a los pacientes a lo largo del estudio.
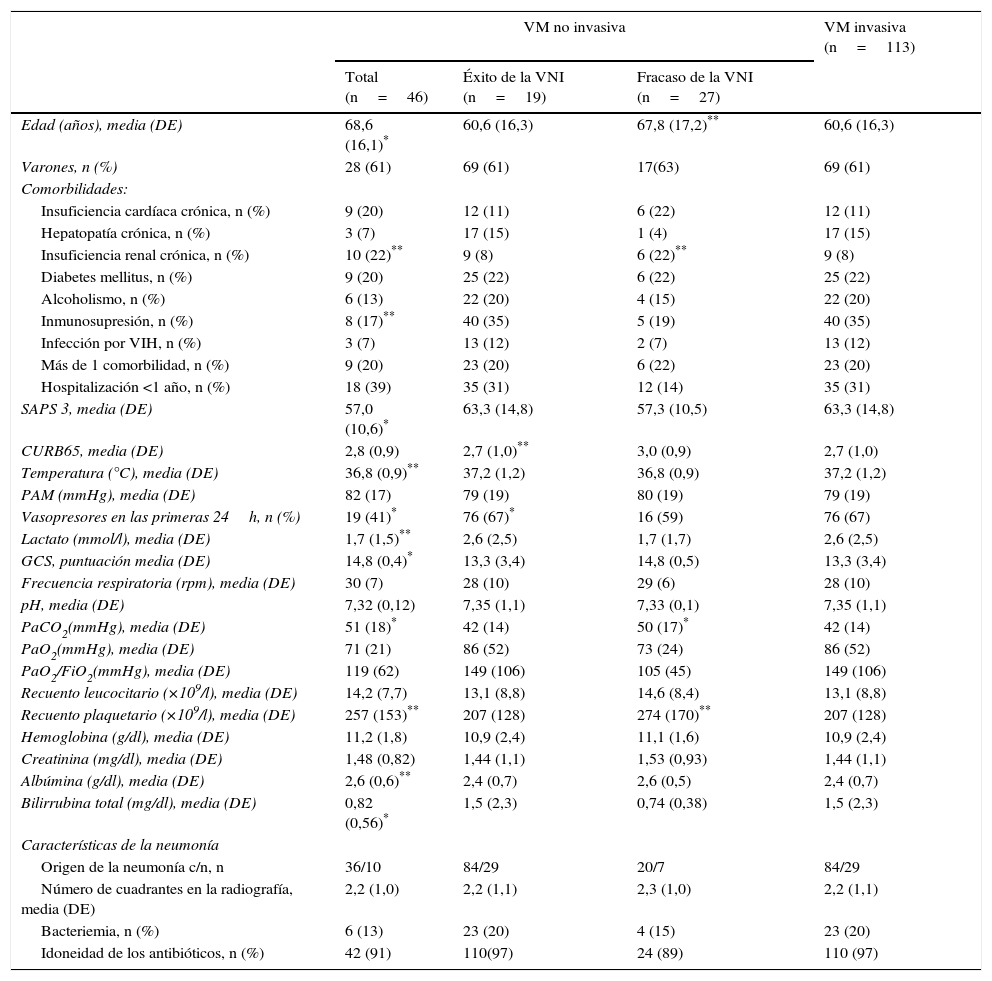
En función del primer tipo de asistencia respiratoria aplicada, se observó que los pacientes con VM invasiva inicial eran más jóvenes; la proporción de insuficiencia renal crónica y la de inmunosupresión en este grupo era más alta; eran enfermos más graves (por SAPS 3, proporción de fármacos vasoactivos requeridos, concentraciones de lactato, puntuación en la GCS, y concentraciones de albúmina y de bilirrubina total); y sus valores de PaCO2 en el momento del ingreso en la UCI eran más bajos que en el caso de los de los pacientes tratados con VNI inicialmente (tabla 1).
Características demográficas y clínicas de todos los pacientes sin EPOC con neumonía en función de la asistencia respiratoria aplicada
| VM no invasiva | VM invasiva (n=113) | |||
|---|---|---|---|---|
| Total (n=46) | Éxito de la VNI (n=19) | Fracaso de la VNI (n=27) | ||
| Edad (años), media (DE) | 68,6 (16,1)* | 60,6 (16,3) | 67,8 (17,2)** | 60,6 (16,3) |
| Varones, n (%) | 28 (61) | 69 (61) | 17(63) | 69 (61) |
| Comorbilidades: | ||||
| Insuficiencia cardíaca crónica, n (%) | 9 (20) | 12 (11) | 6 (22) | 12 (11) |
| Hepatopatía crónica, n (%) | 3 (7) | 17 (15) | 1 (4) | 17 (15) |
| Insuficiencia renal crónica, n (%) | 10 (22)** | 9 (8) | 6 (22)** | 9 (8) |
| Diabetes mellitus, n (%) | 9 (20) | 25 (22) | 6 (22) | 25 (22) |
| Alcoholismo, n (%) | 6 (13) | 22 (20) | 4 (15) | 22 (20) |
| Inmunosupresión, n (%) | 8 (17)** | 40 (35) | 5 (19) | 40 (35) |
| Infección por VIH, n (%) | 3 (7) | 13 (12) | 2 (7) | 13 (12) |
| Más de 1 comorbilidad, n (%) | 9 (20) | 23 (20) | 6 (22) | 23 (20) |
| Hospitalización <1 año, n (%) | 18 (39) | 35 (31) | 12 (14) | 35 (31) |
| SAPS 3, media (DE) | 57,0 (10,6)* | 63,3 (14,8) | 57,3 (10,5) | 63,3 (14,8) |
| CURB65, media (DE) | 2,8 (0,9) | 2,7 (1,0)** | 3,0 (0,9) | 2,7 (1,0) |
| Temperatura (°C), media (DE) | 36,8 (0,9)** | 37,2 (1,2) | 36,8 (0,9) | 37,2 (1,2) |
| PAM (mmHg), media (DE) | 82 (17) | 79 (19) | 80 (19) | 79 (19) |
| Vasopresores en las primeras 24h, n (%) | 19 (41)* | 76 (67)* | 16 (59) | 76 (67) |
| Lactato (mmol/l), media (DE) | 1,7 (1,5)** | 2,6 (2,5) | 1,7 (1,7) | 2,6 (2,5) |
| GCS, puntuación media (DE) | 14,8 (0,4)* | 13,3 (3,4) | 14,8 (0,5) | 13,3 (3,4) |
| Frecuencia respiratoria (rpm), media (DE) | 30 (7) | 28 (10) | 29 (6) | 28 (10) |
| pH, media (DE) | 7,32 (0,12) | 7,35 (1,1) | 7,33 (0,1) | 7,35 (1,1) |
| PaCO2(mmHg), media (DE) | 51 (18)* | 42 (14) | 50 (17)* | 42 (14) |
| PaO2(mmHg), media (DE) | 71 (21) | 86 (52) | 73 (24) | 86 (52) |
| PaO2/FiO2(mmHg), media (DE) | 119 (62) | 149 (106) | 105 (45) | 149 (106) |
| Recuento leucocitario (×109/l), media (DE) | 14,2 (7,7) | 13,1 (8,8) | 14,6 (8,4) | 13,1 (8,8) |
| Recuento plaquetario (×109/l), media (DE) | 257 (153)** | 207 (128) | 274 (170)** | 207 (128) |
| Hemoglobina (g/dl), media (DE) | 11,2 (1,8) | 10,9 (2,4) | 11,1 (1,6) | 10,9 (2,4) |
| Creatinina (mg/dl), media (DE) | 1,48 (0,82) | 1,44 (1,1) | 1,53 (0,93) | 1,44 (1,1) |
| Albúmina (g/dl), media (DE) | 2,6 (0,6)** | 2,4 (0,7) | 2,6 (0,5) | 2,4 (0,7) |
| Bilirrubina total (mg/dl), media (DE) | 0,82 (0,56)* | 1,5 (2,3) | 0,74 (0,38) | 1,5 (2,3) |
| Características de la neumonía | ||||
| Origen de la neumonía c/n, n | 36/10 | 84/29 | 20/7 | 84/29 |
| Número de cuadrantes en la radiografía, media (DE) | 2,2 (1,0) | 2,2 (1,1) | 2,3 (1,0) | 2,2 (1,1) |
| Bacteriemia, n (%) | 6 (13) | 23 (20) | 4 (15) | 23 (20) |
| Idoneidad de los antibióticos, n (%) | 42 (91) | 110(97) | 24 (89) | 110 (97) |
En las columnas de VNI, los símbolos indican diferencias entre el conjunto de grupos de VNI y el grupo de VM invasiva. Los símbolos en la columna de éxito de la VNI indican diferencias entre los grupos de éxito y de fracaso de la VNI. Los símbolos en la columna de fracaso de la VNI indican diferencias entre los grupos de fracaso de la VNI y de VM invasiva.
c/n: comunitaria/nosocomial; DE: desviación estándar; VIH: virus de la inmunodeficiencia humana; PAM: presión arterial media; GCS: Glascow Coma Score; VM: ventilación mecánica; VNI: ventilación mecánica no invasiva.
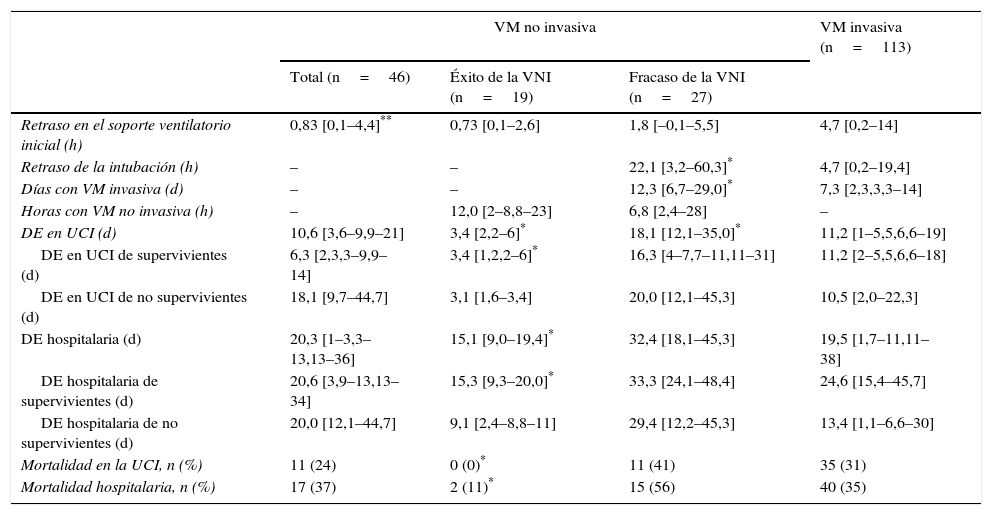
El grupo de pacientes en el que el uso inicial de VNI fracasó precisó dosis más altas de fármacos vasoactivos y mostró puntuaciones CURB65 más altas respecto al grupo en el que la VNI fue exitosa (tabla 1). El uso de fármacos vasoactivos se asoció con fracaso de la VNI, con una oportunidad relativa de 7,8 (IC 95%, 1,8 a 33,2), p=0,006. En los pacientes con éxito de la VNI, las duraciones de la estancia en UCI y de la estancia hospitalaria fueron más cortas que en los pacientes con fracaso de la VNI, mientras que la duración de la VNI fue similar en ambos grupos (tabla 2). El fracaso de la VNI se consideró precoz en diecinueve (70%) pacientes.
Características de los resultados de los diferentes grupos de soporte ventilatorio. Para las variables continuas, se indica la mediana y el rango intercuartílico
| VM no invasiva | VM invasiva (n=113) | |||
|---|---|---|---|---|
| Total (n=46) | Éxito de la VNI (n=19) | Fracaso de la VNI (n=27) | ||
| Retraso en el soporte ventilatorio inicial (h) | 0,83 [0,1–4,4]** | 0,73 [0,1–2,6] | 1,8 [–0,1–5,5] | 4,7 [0,2–14] |
| Retraso de la intubación (h) | – | – | 22,1 [3,2–60,3]* | 4,7 [0,2–19,4] |
| Días con VM invasiva (d) | – | – | 12,3 [6,7–29,0]* | 7,3 [2,3,3,3–14] |
| Horas con VM no invasiva (h) | – | 12,0 [2–8,8–23] | 6,8 [2,4–28] | – |
| DE en UCI (d) | 10,6 [3,6–9,9–21] | 3,4 [2,2–6]* | 18,1 [12,1–35,0]* | 11,2 [1–5,5,6,6–19] |
| DE en UCI de supervivientes (d) | 6,3 [2,3,3–9,9–14] | 3,4 [1,2,2–6]* | 16,3 [4–7,7–11,11–31] | 11,2 [2–5,5,6,6–18] |
| DE en UCI de no supervivientes (d) | 18,1 [9,7–44,7] | 3,1 [1,6–3,4] | 20,0 [12,1–45,3] | 10,5 [2,0–22,3] |
| DE hospitalaria (d) | 20,3 [1–3,3–13,13–36] | 15,1 [9,0–19,4]* | 32,4 [18,1–45,3] | 19,5 [1,7–11,11–38] |
| DE hospitalaria de supervivientes (d) | 20,6 [3,9–13,13–34] | 15,3 [9,3–20,0]* | 33,3 [24,1–48,4] | 24,6 [15,4–45,7] |
| DE hospitalaria de no supervivientes (d) | 20,0 [12,1–44,7] | 9,1 [2,4–8,8–11] | 29,4 [12,2–45,3] | 13,4 [1,1–6,6–30] |
| Mortalidad en la UCI, n (%) | 11 (24) | 0 (0)* | 11 (41) | 35 (31) |
| Mortalidad hospitalaria, n (%) | 17 (37) | 2 (11)* | 15 (56) | 40 (35) |
En las columnas de VNI, los símbolos indican diferencias entre el conjunto de grupos de VNI y el grupo de VM invasiva. Los símbolos en la columna de éxito de la VNI indican diferencias entre los grupos de éxito y de fracaso de la VNI. Los símbolos en la columna de fracaso de la VNI indican diferencias entre los grupos de fracaso de la VNI y de VM invasiva.
DE: duración de la estancia; VM: ventilación mecánica; VNI: ventilación mecánica no invasiva; UCI: unidad de cuidados intensivos.
El inicio de soporte respiratorio se retrasó más en el grupo con VM invasiva inicial que en el que se conectó a VNI inicialmente (p=0,01). No se observaron diferencias significativas entre los grupos de fracaso y de éxito de la VNI, ni entre los grupos de VM invasiva de primera línea y de fracaso de la VNI (tabla 2).
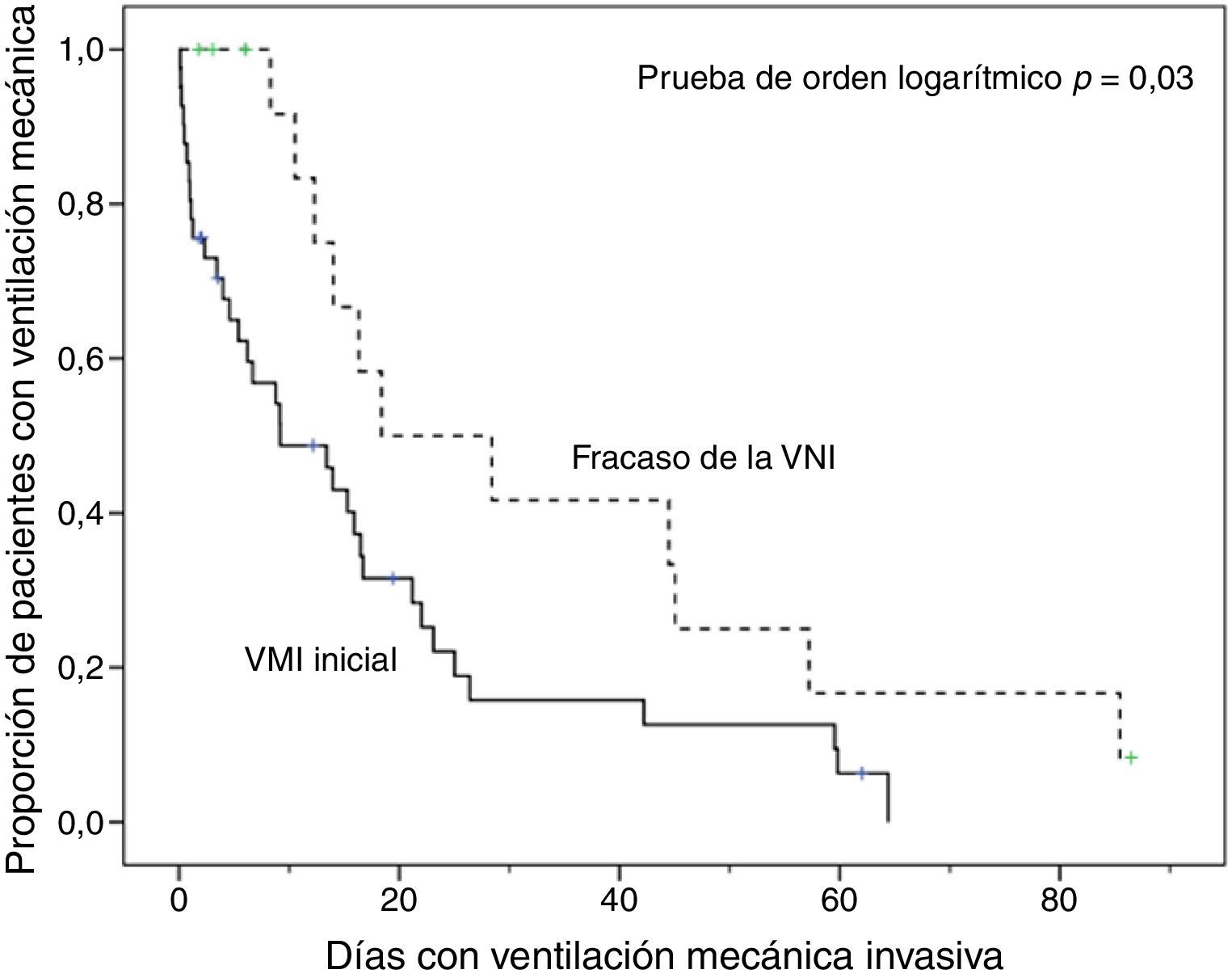
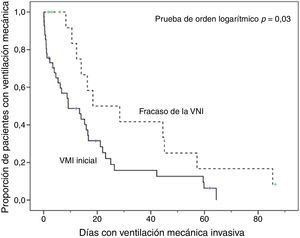
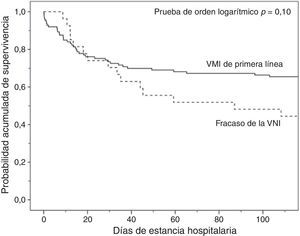
En comparación con los pacientes que en primera instancia recibieron VM invasiva, los pacientes con fracaso de la VNI eran mayores, presentaron mayor porcentaje de insuficiencia renal crónica y valores de PaCO2 más altos (tabla 1). Además, en este grupo de pacientes, la intubación fue más tardía (p<0,001) y las duraciones de la VM invasiva y de la estancia en la UCI fueron más prolongadas, p=0,007 (fig. 2) y p=0,001 (tabla 2), respectivamente.
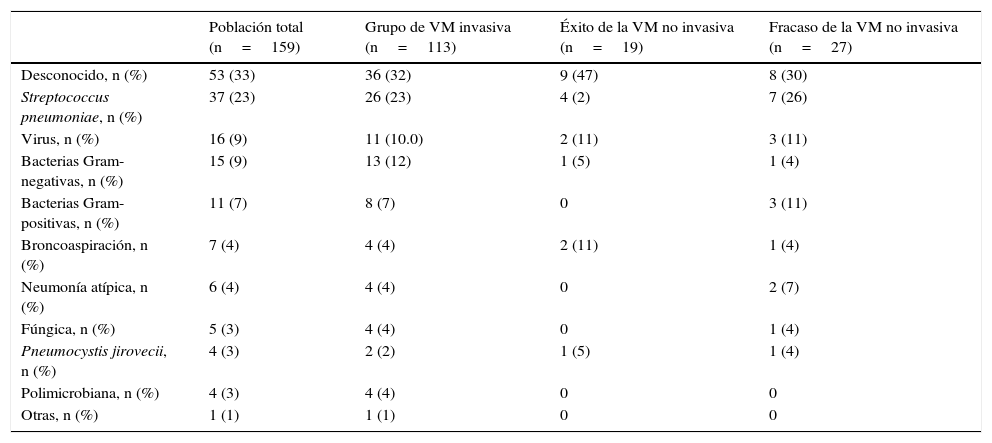
En relación a las características clínicas de la neumonía, no se observaron diferencias significativas entre los grupos de tratamiento (tabla 1). En total, siete pacientes (4%) recibieron un tratamiento antibiótico inicial inadecuado; tres en el grupo de VM invasiva (Pseudomonas aeruginosa, virus Herpes simplex más virus Influenza H1N1 y virus Herpes simplex), tres en el grupo de fracaso de la VNI (Enterococcus faecium, Aspergillus fumigatus y virus Herpes simplex) y uno en el grupo de éxito de la VNI (virus Influenza H1N1). En la tabla 3 se presentan los diagnósticos microbiológicos de las neumonías.
Diagnósticos microbiológicos de las neumonías de todos los pacientes
| Población total (n=159) | Grupo de VM invasiva (n=113) | Éxito de la VM no invasiva (n=19) | Fracaso de la VM no invasiva (n=27) | |
|---|---|---|---|---|
| Desconocido, n (%) | 53 (33) | 36 (32) | 9 (47) | 8 (30) |
| Streptococcus pneumoniae, n (%) | 37 (23) | 26 (23) | 4 (2) | 7 (26) |
| Virus, n (%) | 16 (9) | 11 (10.0) | 2 (11) | 3 (11) |
| Bacterias Gram-negativas, n (%) | 15 (9) | 13 (12) | 1 (5) | 1 (4) |
| Bacterias Gram-positivas, n (%) | 11 (7) | 8 (7) | 0 | 3 (11) |
| Broncoaspiración, n (%) | 7 (4) | 4 (4) | 2 (11) | 1 (4) |
| Neumonía atípica, n (%) | 6 (4) | 4 (4) | 0 | 2 (7) |
| Fúngica, n (%) | 5 (3) | 4 (4) | 0 | 1 (4) |
| Pneumocystis jirovecii, n (%) | 4 (3) | 2 (2) | 1 (5) | 1 (4) |
| Polimicrobiana, n (%) | 4 (3) | 4 (4) | 0 | 0 |
| Otras, n (%) | 1 (1) | 1 (1) | 0 | 0 |
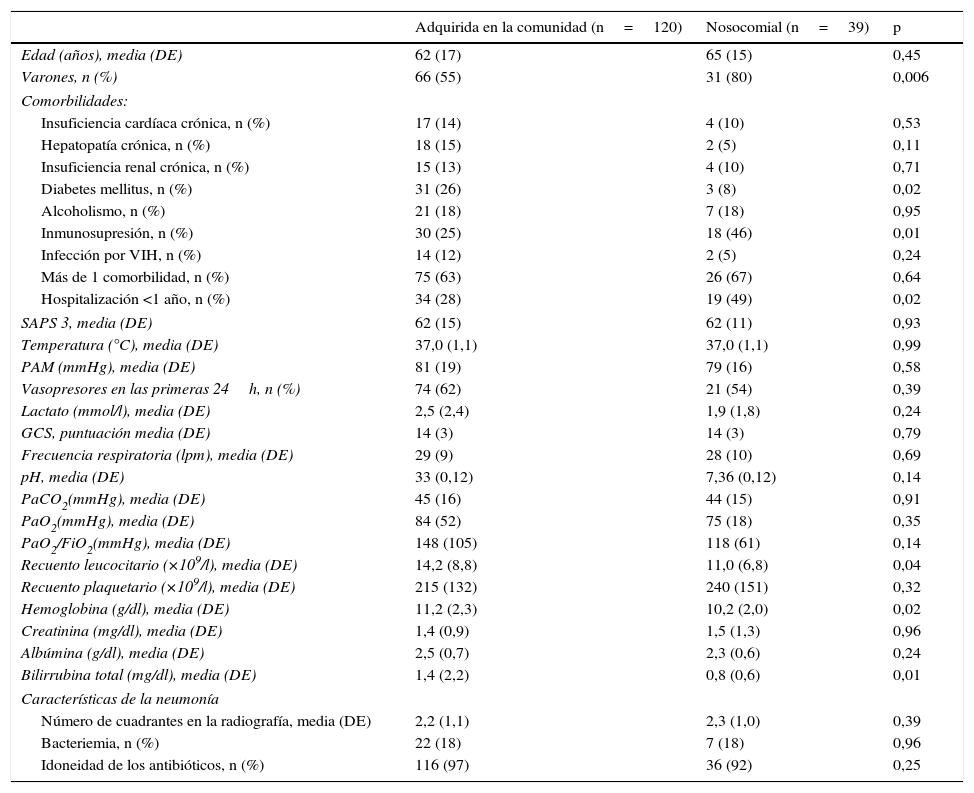
Los pacientes con neumonía nosocomial eran mayoritariamente varones y presentaban más comorbilidades, recuentos leucocitarios y concentraciones de bilirrubina más bajos que los pacientes con neumonía adquirida en la comunidad (Anexo 2). Asimismo, sus estancias fueron más prolongadas (diferencia media de 17 días (IC 95%, 7-28 días, p=0,009).
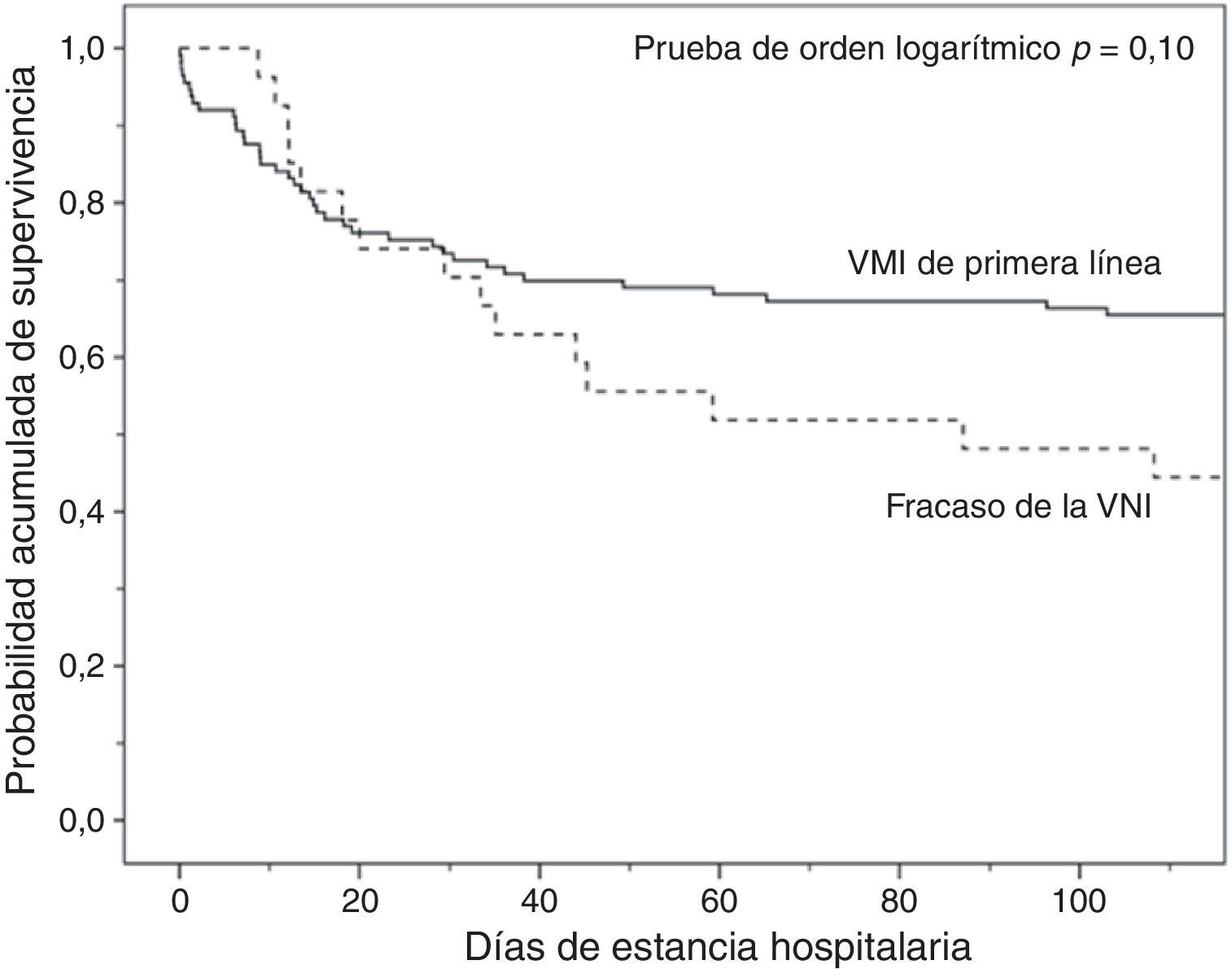
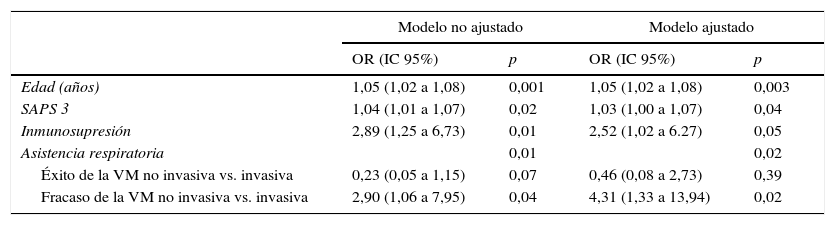
Análisis de la mortalidadEn el análisis univariante (tabla 2), los pacientes tratados inicialmente con VM invasiva no presentaron diferencias significativas en la mortalidad hospitalaria en comparación a los pacientes tratados con VNI inicial (37%) ni con los pacientes que fracasaron en la VNI (56%) (tabla 2), aunque esta última diferencia fue clínicamente importante (fig. 3). En el análisis multivariante de todos los pacientes que recibieron soporte ventilatorio (invasivo y no invasivo), las variables que se asociaron con la mortalidad hospitalaria en el modelo final fueron la edad, la puntuación SAPS 3, la inmunosupresión y el fracaso de la VNI, en comparación con VM invasiva de primera línea (tabla 4). Al ajustar este modelo al índice de propensión de recibir VM invasiva o VNI de primera línea como covariable explicativa, el riesgo de muerte aumentó 4,31 veces (IC 95%, 1,33-13,94; p=0,02) en los pacientes con fracaso de la VNI, en comparación con aquellos que fueron sometidos a VM invasiva de primera línea (tabla 4). El área bajo la curva del modelo del score de propensión fue de 0,82 (IC 95%, 0,74-0,89).
Análisis de regresión logística de la mortalidad hospitalaria en todos los pacientes con asistencia respiratoria. La asistencia respiratoria se ha categorizado tomando como referencia la VM invasiva como tratamiento inicial. Se muestra el modelo antes y después de ajustarlo al índice de propensión y de ser conectado a VM invasiva como primer tratamiento ventilatorio
| Modelo no ajustado | Modelo ajustado | |||
|---|---|---|---|---|
| OR (IC 95%) | p | OR (IC 95%) | p | |
| Edad (años) | 1,05 (1,02 a 1,08) | 0,001 | 1,05 (1,02 a 1,08) | 0,003 |
| SAPS 3 | 1,04 (1,01 a 1,07) | 0,02 | 1,03 (1,00 a 1,07) | 0,04 |
| Inmunosupresión | 2,89 (1,25 a 6,73) | 0,01 | 2,52 (1,02 a 6.27) | 0,05 |
| Asistencia respiratoria | 0,01 | 0,02 | ||
| Éxito de la VM no invasiva vs. invasiva | 0,23 (0,05 a 1,15) | 0,07 | 0,46 (0,08 a 2,73) | 0,39 |
| Fracaso de la VM no invasiva vs. invasiva | 2,90 (1,06 a 7,95) | 0,04 | 4,31 (1,33 a 13,94) | 0,02 |
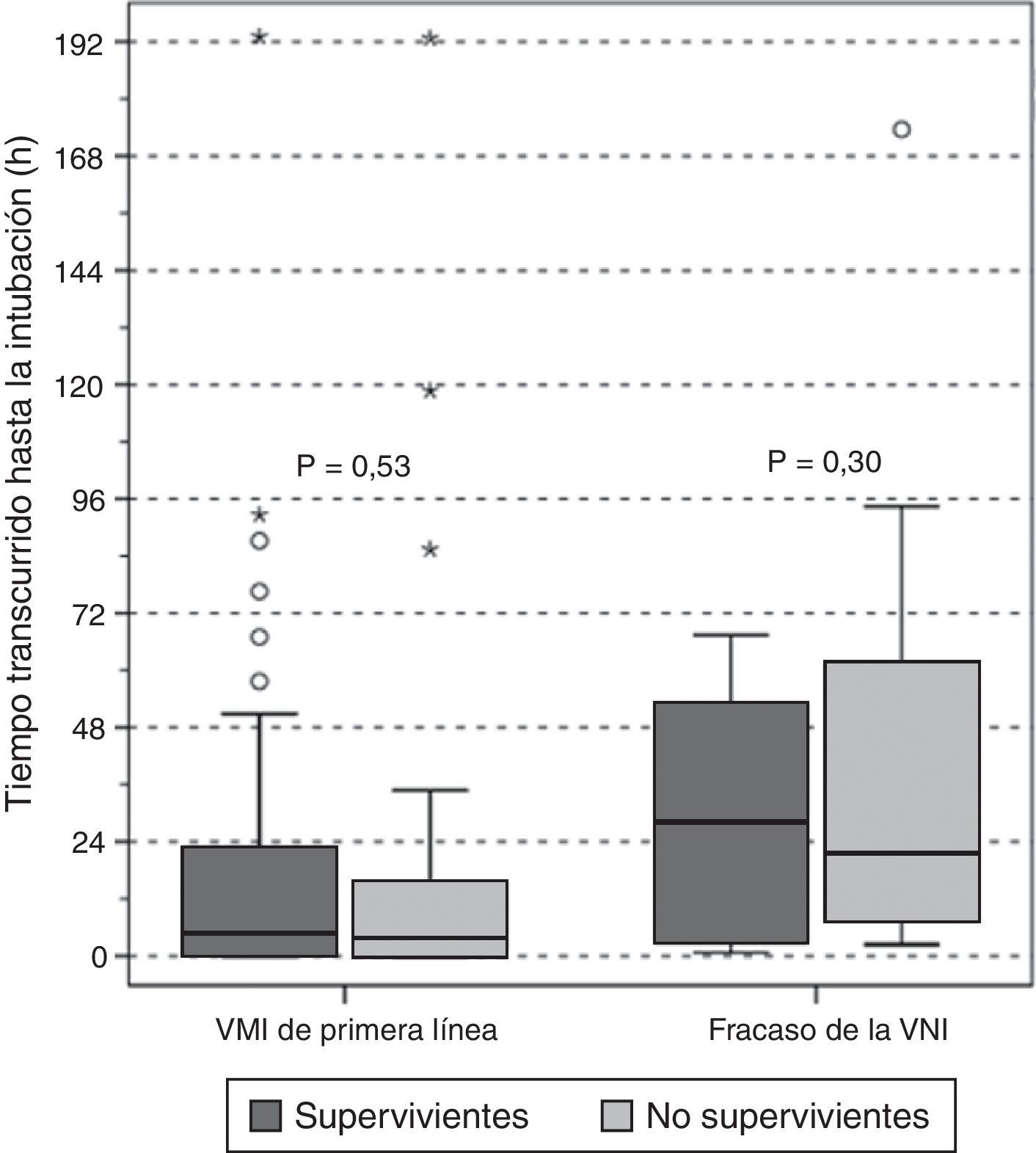
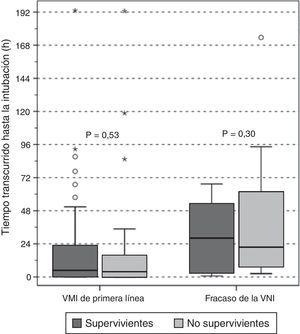
En los grupos de VM invasiva de primera línea y de fracaso de la VNI no hubo diferencias entre supervivientes y no supervivientes según el tiempo de retraso de la intubación (fig. 4); entre los pacientes con fracaso precoz y tardío de la VNI no se observaron diferencias en la mortalidad hospitalaria (50 vs. 58%, p=0,5, respectivamente). Además, al evaluar conjuntamente a los pacientes intubados, no se observó ninguna asociación entre el retraso de la intubación y la mortalidad hospitalaria (OR 1,01 [IC 95%, 1,00-1,01], p=0,36).
Retraso en la intubación en supervivientes (cajas gris oscuro) y no supervivientes (cajas gris claro) en función de la asistencia respiratoria utilizada en primer lugar. Los resultados se muestran con un diagrama de caja (mediana y rango intercuartílico).
VMI: ventilación mecánica invasiva; VNI: ventilación mecánica no invasiva.
En nuestro estudio, la aplicación de VNI de primera línea a pacientes sin EPOC con neumonía ingresados en la UCI no se asoció a un tiempo de ingreso más corto ni una reducción de la mortalidad hospitalaria, en comparación con el tratamiento con VM invasiva de primera línea. De hecho, la tasa de fracaso de la VNI con necesidad de tratamiento de rescate mediante VM invasiva fue alta y se asoció con mala evolución, prolongación de las estancias en UCI y hospital, mayor duración de la VM invasiva. En el análisis multivariante ajustado, se relacionó además con mayor mortalidad hospitalaria, en comparación con la VM invasiva de primera línea.
El presente estudio acrecienta la preocupación ya existente por los efectos nocivos del fracaso de la VNI en estos pacientes1,7,12,13,18,28,29, puesto que los pacientes que inicialmente no cumplían los criterios de VM invasiva y a priori parecían tener un pronóstico más favorable por presentar puntuaciones SAPS 3 más bajas, finalmente evolucionaron peor que aquellos a los que se intubó directamente.
Desde los años 90, existe cierta controversia respecto a los efectos de la VNI en comparación con la oxigenoterapia convencional en pacientes con insuficiencia respiratoria aguda hipoxémica que no esté causada por insuficiencia cardíaca aguda o exacerbación de la EPOC. El uso es particularmente controvertido en pacientes inmunocompetentes con neumonía o con síndrome de distrés respiratorio agudo. Algunos estudios han descrito efectos beneficiosos en relación con los porcentajes de intubación6,20 o la mortalidad20, mientras que otros han advertido de sus efectos potencialmente perjudiciales en caso de fracaso1,9,11–13,15,18,21,30–32, especialmente en pacientes que no padecen EPOC7,9,11. Es probable que esta discordancia entre trabajos sea debida a diferencias en los tipos de estudio (ensayos clínicos, registros y series de casos) o en la casuística de pacientes, a la variabilidad en la gravedad de los participantes21,33 y a diferencias en los criterios de exclusión de los estudios.
Para minimizar estos errores, en nuestro estudio excluimos a los pacientes con EPOC, aquellos con orden de no reanimar y los que no precisaban soporte ventilatorio. La exclusión de los pacientes con EPOC o con orden de no reanimar confirió solidez a nuestros resultados, debido a que en el análisis de los efectos de la VNI sobre la evolución de pacientes con neumonía existen factores de confusión6,34. La exclusión de los pacientes que en ningún momento precisaron asistencia respiratoria, a diferencia de los estudios aleatorizados6,20,32, nos permitió comparar los efectos de ambos tipos de asistencia en los casos en los que la oxigenoterapia, junto con el tratamiento médico, se consideró insuficiente, y contribuyó a asegurar que el análisis no incluía pacientes que habían recibido asistencia respiratoria innecesaria. Asimismo, en nuestro centro, los pacientes con neumonía que precisaron soporte ventilatorio o tratamiento vasoactivo fueron ingresados en la UCI, y es improbable que se haya introducido un sesgo en la selección de los pacientes, aparte del relativo a la decisión del equipo médico responsable de iniciar asistencia respiratoria.
Los niveles de PaCO2 fueron más altos entre los pacientes tratados con VNI que en aquellos que recibieron VM invasiva de primera línea. Puesto que los pacientes con EPOC fueron excluidos del estudio, la hipercapnia probablemente se debió a insuficiencia respiratoria aguda, ya que se acompañó de acidosis leve, sin que se observasen diferencias entre grupos en la GCS.
La tasa de fracaso de la VNI fue mayor que en ensayos clínicos6,20,32,34,35, pero similar a las descritas en estudios observacionales1,7,9–11,13. Nuestros pacientes eran pacientes críticos: un 60% precisó fármacos vasoactivos, y la mortalidad hospitalaria global fue de un 36%, porcentaje que concuerda con el esperado de acuerdo a las puntuaciones SAPS 326. Respecto a las comorbilidades, los pacientes del grupo de VNI de primera línea eran de mayor edad y con mayor proporción de insuficiencia renal crónica que en el grupo tratado con VM invasiva de primera línea. Por el contrario, las puntuaciones SAPS 3 y el porcentaje de inmunosupresión fueron más altos en el grupo de VM invasiva de primera línea, lo que es indicativo de que los pacientes de este grupo eran más graves.
Pese a la rápida aplicación de la primera técnica ventilatoria, VM invasiva o VNI, los pacientes en los que la VNI fracasó fueron intubados con un retraso clínicamente significativo, en comparación con los pacientes tratados con VM invasiva de primera línea.
Queremos resaltar que la mortalidad hospitalaria fue mayor en el grupo con fracaso de la VNI que en el grupo tratado con VM invasiva (56 vs. 35%), aunque la diferencia no alcanzó la significación estadística, probablemente debido al pequeño tamaño de la muestra. En algunos estudios, el retraso de la intubación tras el fracaso de la VNI se ha asociado con mayor mortalidad8. Esta mala evolución se podría explicar por disnea persistente durante el tratamiento con VNI, que causaría mayor trabajo respiratorio y que finalmente conduciría a la intubación. Además, la intubación y sedación tempranas pueden reducir el trabajo respiratorio, los episodios de falta de sincronía y el biotrauma36. Eventualmente, los altos volúmenes corrientes administrados durante la VNI también podrían haber incrementado el daño pulmonar inducido por el ventilador17 y, en consecuencia, la mortalidad37. Desafortunadamente, no registramos datos de los parámetros fisiológicos y ventilatorios del periodo de VNI. Moister et al.18 también hallaron un aumento de complicaciones de la intubación en pacientes en los que la VNI había fracasado, en comparación con aquellos a los que se intubó directamente. Estos argumentos podrían explicar, en parte, el aumento de mortalidad observado en los pacientes con fracaso de la VNI. No obstante, en nuestro estudio no se observó ninguna asociación entre el retraso de la intubación y la mortalidad. Del mismo modo, Thille et al.30, no observaron diferencias en el tiempo transcurrido hasta la intubación al comparar supervivientes y no supervivientes, mostrando valores muy parecidos a los nuestros y contrapuestos a los descritos por Carrillo et al.8. Esa falta de asociación con un aumento de la mortalidad podría quizás explicarse por la brevedad del retraso de la intubación en nuestro estudio, puesto que un 70% de pacientes fueron intubados en el plazo de 48h. Además, no observamos diferencias entre grupos respecto a la idoneidad del tratamiento antibiótico que pudieran explicar las diferencias observadas en la mortalidad, y el microorganismo causante no se identificó en más de un tercio de los pacientes, tal como se ha descrito en otros trabajos38. En nuestro estudio, los pacientes con fracaso de la VNI precisaron, inevitablemente, VM invasiva, pero desconocemos si la VNI habría sido satisfactoria en algunos de los pacientes que recibieron VM invasiva de primera línea. No podemos descartar que el fracaso de la VNI, más que un factor que empeore el pronóstico, sea un marcador de gravedad que otros indicadores no han podido detectar (SAPS 3 o necesidad de fármacos vasoactivos).
En la práctica clínica, determinar si un paciente sin EPOC con neumonía grave debe ser intubado directamente o se debe probar el tratamiento VNI es una decisión que se debe tomar con prontitud. En nuestro estudio, la única variable asociada con el fracaso de la VNI fue el uso de fármacos vasoactivos en las primeras 24h desde el ingreso en la UCI, lo que concuerda con lo observado en otros estudios13,30. Cabe señalar que los parámetros respiratorios asociados con la gravedad de la neumonía, como la oxigenación (determinada mediante el cociente PaO2/FiO2), el número de cuadrantes afectados en la radiografía o la presencia de bacteriemia, no difirieron entre los pacientes con éxito y fracaso de la VNI.
Entre las limitaciones de nuestro estudio, debemos subrayar su carácter unicéntrico y retrospectivo, lo que obliga a considerar estos resultados con precaución. En segundo lugar, para determinar la necesidad o el tipo de asistencia respiratoria no se siguió un protocolo, sino que la decisión se tomó a criterio del equipo médico responsable del paciente. Tercero, no registramos la cronología de la administración del tratamiento médico no ventilatorio inicial, como, por ejemplo, antibióticos o reposición del volumen de fluidos. Cuarto, durante el periodo del estudio se introdujeron cambios en la política de tratamiento del centro, como la implementación de la Campaña para sobrevivir a la sepsis39, que podrían haber modificado la evolución de los pacientes. Por último, la heterogeneidad en las características basales de los diferentes grupos por tipo de asistencia respiratoria podría haber inducido a errores en la interpretación de los resultados. Para reducir al mínimo estas importantes deficiencias, ajustamos el análisis de mortalidad por índice de propensión, que definió la probabilidad de intubación en primera instancia de acuerdo con algunas covariables del sujeto, aunque el método utilizado no es capaz de eliminar completamente el sesgo en la asignación del tratamiento40.
ConclusionesLa evolución de los pacientes sin EPOC con neumonía que precisaban asistencia respiratoria y que en primera instancia fueron conectados a VNI no fue mejor que la de los pacientes inicialmente conectados a VM invasiva. El fracaso de la VNI se asoció con mayor duración de VM, estancia en la UCI más prolongada y mayor mortalidad hospitalaria, en comparación con los pacientes tratados con VM invasiva de primera línea. La necesidad de fármacos vasoactivos disuade de aplicar VNI de primera línea, debido a que se ha observado un alto porcentaje de fracasos de la VNI.
Autoría/colaboradoresBúsqueda bibliográfica: Gemma Rialp, Daniel Muñiz, Maria Romero.
Recogida de datos: Gemma Rialp, Catalina Forteza, Daniel Muñiz, Maria Romero.
Diseño del estudio: Gemma Rialp.
Análisis de los datos: Gemma Rialp.
Preparación del manuscrito: Gemma Rialp, Catalina Forteza.
Revisión del manuscrito: Daniel Muñiz, Maria Romero.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Histograma de la asistencia respiratoria utilizada a lo largo del periodo de estudio (barra negra, grupo de ventilación mecánica invasiva; barra gris, grupo de éxito de la ventilación mecánica no invasiva; y barra blanca, grupo de fracaso de la ventilación mecánica no invasiva). El tiempo se muestra en cuartiles.
| Adquirida en la comunidad (n=120) | Nosocomial (n=39) | p | |
|---|---|---|---|
| Edad (años), media (DE) | 62 (17) | 65 (15) | 0,45 |
| Varones, n (%) | 66 (55) | 31 (80) | 0,006 |
| Comorbilidades: | |||
| Insuficiencia cardíaca crónica, n (%) | 17 (14) | 4 (10) | 0,53 |
| Hepatopatía crónica, n (%) | 18 (15) | 2 (5) | 0,11 |
| Insuficiencia renal crónica, n (%) | 15 (13) | 4 (10) | 0,71 |
| Diabetes mellitus, n (%) | 31 (26) | 3 (8) | 0,02 |
| Alcoholismo, n (%) | 21 (18) | 7 (18) | 0,95 |
| Inmunosupresión, n (%) | 30 (25) | 18 (46) | 0,01 |
| Infección por VIH, n (%) | 14 (12) | 2 (5) | 0,24 |
| Más de 1 comorbilidad, n (%) | 75 (63) | 26 (67) | 0,64 |
| Hospitalización <1 año, n (%) | 34 (28) | 19 (49) | 0,02 |
| SAPS 3, media (DE) | 62 (15) | 62 (11) | 0,93 |
| Temperatura (°C), media (DE) | 37,0 (1,1) | 37,0 (1,1) | 0,99 |
| PAM (mmHg), media (DE) | 81 (19) | 79 (16) | 0,58 |
| Vasopresores en las primeras 24h, n (%) | 74 (62) | 21 (54) | 0,39 |
| Lactato (mmol/l), media (DE) | 2,5 (2,4) | 1,9 (1,8) | 0,24 |
| GCS, puntuación media (DE) | 14 (3) | 14 (3) | 0,79 |
| Frecuencia respiratoria (lpm), media (DE) | 29 (9) | 28 (10) | 0,69 |
| pH, media (DE) | 33 (0,12) | 7,36 (0,12) | 0,14 |
| PaCO2(mmHg), media (DE) | 45 (16) | 44 (15) | 0,91 |
| PaO2(mmHg), media (DE) | 84 (52) | 75 (18) | 0,35 |
| PaO2/FiO2(mmHg), media (DE) | 148 (105) | 118 (61) | 0,14 |
| Recuento leucocitario (×109/l), media (DE) | 14,2 (8,8) | 11,0 (6,8) | 0,04 |
| Recuento plaquetario (×109/l), media (DE) | 215 (132) | 240 (151) | 0,32 |
| Hemoglobina (g/dl), media (DE) | 11,2 (2,3) | 10,2 (2,0) | 0,02 |
| Creatinina (mg/dl), media (DE) | 1,4 (0,9) | 1,5 (1,3) | 0,96 |
| Albúmina (g/dl), media (DE) | 2,5 (0,7) | 2,3 (0,6) | 0,24 |
| Bilirrubina total (mg/dl), media (DE) | 1,4 (2,2) | 0,8 (0,6) | 0,01 |
| Características de la neumonía | |||
| Número de cuadrantes en la radiografía, media (DE) | 2,2 (1,1) | 2,3 (1,0) | 0,39 |
| Bacteriemia, n (%) | 22 (18) | 7 (18) | 0,96 |
| Idoneidad de los antibióticos, n (%) | 116 (97) | 36 (92) | 0,25 |
DE: desviación estándar; GCS: Glasgow Coma Scale; PAM: presión arterial media; VIH: virus de la inmunodeficiencia humana.