Se evaluó el tratamiento con antibióticos intravenosos en combinación con la fisioterapia respiratoria intensiva para las exacerbaciones pulmonares agudas de las infecciones crónicas por Pseudomonas aeruginosa en pacientes con fibrosis quística. Durante la hospitalización y el alta se evaluó la técnica de espiración forzada (TEF). El objetivo de este estudio fue 1) valorar los efectos inmediatos de la TEF y de 2) los antibióticos intravenosos combinados con la fisioterapia respiratoria diaria (AI+FTR) sobre los parámetros de función pulmonar, antropometría corporal y puntuaciones clínicas de pacientes con fibrosis quística y exacerbaciones pulmonares agudas de una infección crónica por Pseudomonas aeruginosa en la hospitalización y el momento del alta hospitalaria tras remisión de la infección.
Pacientes y métodosEn un estudio clínico prospectivo, no controlado, se incluyeron 18 pacientes, de 7–28 años de edad. Antes y después de la hospitalización se evaluaron los valores antropométricos corporales, exacerbación de la puntuación Cystic Fibrosis Clinical Score, Cystic Fibrosis Foundation Score y puntuaciones de gravedad (PG). Antes y después de la TEF, se evaluaron la saturación de oxígeno (SpO2), FC y FR.
ResultadosEn el momento del alta hospitalaria, la Cystic Fibrosis Clinical Score (32,4+7,2) y Cystic Fibrosis Foundation Score (6,4+1,7) habían disminuido 18,9+3,3 y 0,3+0,5, respectivamente (p<0,001). La AI+FTR redujo la FR media (p=0,003) y aumentó la SpO2 (p=0,006), el volumen espiratorio forzado en el primer segundo (p=0,021) y los valores nutricionales (p=0,002). En el momento de la hospitalización, la TEF mejoró de inmediato la FC (p=0,028), FR (p=0,001) y la SpO2 (p=0,015), a pesar de un reducción significativa de la ventilación voluntaria máxima (p=0,028); tras la remisión de la infección, la TEF no alteró significativamente los parámetros.
ConclusiónLa AI+FTR mejoró el estado clínico de los pacientes con fibrosis quística. La TEF mejoró las variables cardiorrespiratorias de los pacientes con riesgo de infección.
Intravenous antibiotics in combination with intensive respiratory physiotherapy were evaluated for acute lung exacerbations in chronic infections of Pseudomonas aeruginosa in cystic fibrosis patients. Forced expiratory technique (FET) was assessed during hospital stay and discharge. The aim of this study was 1) to evaluate the immediate effects of FET and of 2) Intravenous antibiotics in combination with daily respiratory physiotherapy (IA+RPT) on parameters of lung function, body anthropometry and clinical scores of cystic fibrosis patients with acute lung exacerbation with chronic infection by Pseudomonas aeruginosa, during hospital stay and at hospital discharge after clearing the infection.
Patients and methodEighteen patients between 7–28 years old were included in a prospective non-controlled clinical study. Body anthropometry values, Cystic Fibrosis Clinical Score (CFCS) exacerbation, Cystic Fibrosis Foundation Score (CFFS), and severity scores (SS) were evaluated before and after admission. Oxygen saturation (SpO2), heart (HR) and respiratory rate (RR) were evaluated before and after FET.
ResultsCFCS (32.4+7.2) and CFFS (6.4+1.7) had decreased at hospital discharge for 18.9+3.3 and 0.3+0.5, respectively (p<0.001). IA+ RPT reduced RR means (p=0.003) and increased SpO2 (p=0.006), forced expiration volume at 1min (FEV1) (p=0.021) and nutritional values (p=0.002). During admission, FET immediately improved HR (p=0.028), RR (p=0.001) and SpO2 (p=0.015), despite significant maximum voluntary ventilation reduction (p=0.028); after the infection was treated the FET did not significantly alter parameters.
ConclusionIA+RPT improved clinical conditions of cystic fibrosis patients. FET improved cardiorespiratory variables of patients at risk for infection.
Durante las 3 últimas décadas, se han hecho numerosos progresos en el diagnóstico y tratamiento de la fibrosis quística (FQ). Estos progresos se han asociado a un tratamiento multidisciplinario eficaz y a intervenciones terapéuticas agresivas, y han mejorado la esperanza mediana de vida y la calidad de vida de los pacientes1, aunque la infección pulmonar sigue desempeñando un papel destacado en las altas tasas de morbilidad y mortalidad2.
En Brasil, la colonización e infección crónica por Pseudomonas aeruginosa (P. aeruginosa) tiene una incidencia más prematura que en los países desarrollados. La infección puede manifestarse por la exacerbación de los síntomas clínicos, como fiebre, aumento de la tos; aumento del esputo; disnea, disminución del apetito, pérdida de peso, absentismo escolar o laboral; y una disminución de la tolerancia al ejercicio2–4.
Los pacientes que experimentan una exacerbación pulmonar aguda de una infección crónica por Pseudomonas aeruginosa (EPAICP) se caracterizan por un declive rápido de la función pulmonar y un peor pronóstico, lo que depende del número de episodios y el tiempo transcurrido entre ellos2,5,6.
En la mayoría de unidades de referencia regionales para la fibrosis quística se dispone de protocolos de antibioterapia intravenosa (AI) para la EPAICP. Muchas de estas unidades han publicado estudios que describen la mejora de los síntomas respiratorios, parámetros de función pulmonar, calidad de vida y de los marcadores inflamatorios tras AI2,5–8. En unos pocos estudios efectuados en pacientes con EPAICP se evalúan otras intervenciones terapéuticas combinadas con la AI, como las técnicas de fisioterapia respiratoria (FTR)8–10.
La FTR contribuye al aclaramiento de las secreciones broncopulmonares de pacientes FQ con enfermedad pulmonar, con una mejora de la ventilación pulmonar y de su calidad de vida. No hay ninguna técnica para el tratamiento de la FQ que se considere el «patrón oro». Pueden combinarse diversas técnicas y no se dispone de pruebas por lo que respecta a cuáles de estas estrategias son más eficaces y la decisión dependerá de la edad del paciente y de su capacidad para llevar a cabo las maniobras8. Se han descrito beneficios del uso de las técnicas convencionales (percusión, vibración y drenaje postural), actividad física, instrumentos, como el dispositivo Flutter® y mascarilla de presión espiratoria positiva (PEP)8–12. La técnica de espiración forzada (TEF) favorece una independencia relativa del paciente, por lo que también se recomienda11,12. El principio de este tratamiento se basa en la combinación de una o 2 espiraciones forzadas no violentas (o «huffs») con periodos de respiración controlada para prevenir la obstrucción al flujo aéreo. Se sigue de la inducción de tos productiva no extenuante para eliminar las secreciones que se han transportado a vías respiratorias altas debido a la migración en puntos de presión igual. Hay pocos estudios que hayan investigado el efecto de esta técnica sobre las vías respiratorias inestables en presencia de EPAICP, antes y después de la AI.
Hasta el momento actual, después de la combinación de AI+FTR, los exámenes y parámetros sugeridos para tratar la enfermedad pulmonar de la fibrosis quística, incluyen: espirometría, saturación de oxígeno, gasometría, pletismografía, cultivo microbiano, reología del volumen y moco, aspectos nutricionales, hospitalización, cuestionarios, técnicas de diagnóstico por imagen, puntuaciones de valoración y variables clínicas9–14. Se ha demostrado la eficacia de los efectos de la AI sobre la EPAICP8. Sin embargo, todavía no se han presentado marcadores de los efectos de la FTR con una respuesta significativa para incrementar al máximo los beneficios de este procedimiento10–12,15.
El objetivo del presente estudio fue evaluar los efectos inmediatos de la TEF y de la AI+FTR diaria sobre los parámetros de función pulmonar, nutrición y puntuaciones clínicas de pacientes FQ con exacerbación pulmonar aguda de una infección crónica por P. aeruginosa, en el momento de la hospitalización y del alta hospitalaria tras remisión de la infección.
Pacientes y métodosDiseñoEstudio clínico prospectivo, no controlado, llevado a cabo en pacientes con fibrosis quística.
ParticipantesLos pacientes con fibrosis quística procedían de la unidad de referencia de fibrosis quística del Paediatric Department Center for Research in Pediatrics (CIPED)/Pulmonary Physiology Laboratory de la University of Campinas (Universidade Estadual de Campinas/UNICAMP), hospitalizados con EPAICP durante un período de 3 años.
Se incluyeron en el estudio los individuos con un diagnóstico de FQ determinado por un cuadro clínico compatible, 2 pruebas del sudor y un examen genético15, que se presentaron con EPAICP.
De acuerdo con los criterios de consenso europeos, la infección crónica por P. aeruginosa se estableció por la presencia de la bacteria en un mínimo de 3 cultivos, durante un período de 6 meses, con signos directos/indirectos de infección y lesión tisular2.
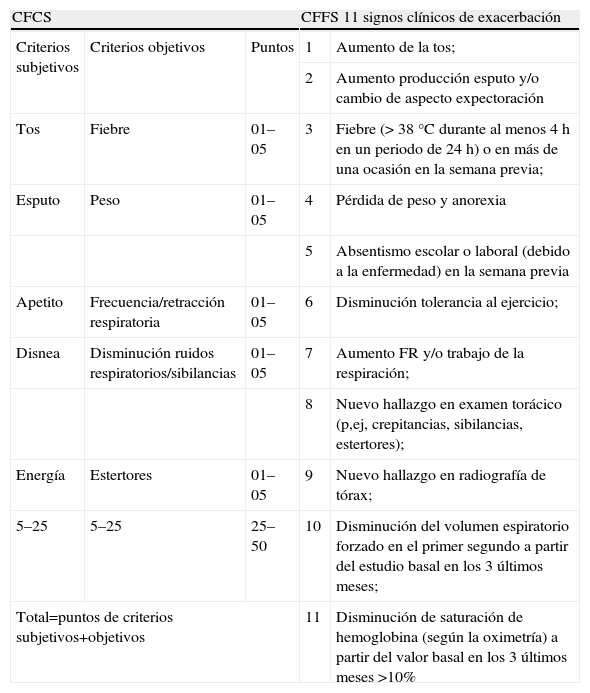
La EPAICP se estableció por los diferentes valores obtenidos durante la aplicación de la Cystic Fibrosis Clinical Score (CFCS) y el sistema de puntuación de la Cystic Fibrosis Foundation Score (CFFS)13,14,16,17. Ambos sistemas evalúan los signos y síntomas de exacerbación pulmonar aguda (tabla 1). La puntuación CFCS consiste en una escala de 5 puntos y la puntuación máxima corresponde al peor estado clínico, que puede ascender a 50 puntos16. La CFFS está constituida por 11 manifestaciones clínicas y la presencia de más de 5 representa una exacerbación pulmonar17.
Puntuación Cystic Fibrosis Clinical Score (CFCS) y puntuación Cystic Fibrosis Foundation Score (CFFS)
| CFCS | CFFS 11 signos clínicos de exacerbación | |||
| Criterios subjetivos | Criterios objetivos | Puntos | 1 | Aumento de la tos; |
| 2 | Aumento producción esputo y/o cambio de aspecto expectoración | |||
| Tos | Fiebre | 01–05 | 3 | Fiebre (> 38°C durante al menos 4h en un periodo de 24h) o en más de una ocasión en la semana previa; |
| Esputo | Peso | 01–05 | 4 | Pérdida de peso y anorexia |
| 5 | Absentismo escolar o laboral (debido a la enfermedad) en la semana previa | |||
| Apetito | Frecuencia/retracción respiratoria | 01–05 | 6 | Disminución tolerancia al ejercicio; |
| Disnea | Disminución ruidos respiratorios/sibilancias | 01–05 | 7 | Aumento FR y/o trabajo de la respiración; |
| 8 | Nuevo hallazgo en examen torácico (p,ej, crepitancias, sibilancias, estertores); | |||
| Energía | Estertores | 01–05 | 9 | Nuevo hallazgo en radiografía de tórax; |
| 5–25 | 5–25 | 25–50 | 10 | Disminución del volumen espiratorio forzado en el primer segundo a partir del estudio basal en los 3 últimos meses; |
| Total=puntos de criterios subjetivos+objetivos | 11 | Disminución de saturación de hemoglobina (según la oximetría) a partir del valor basal en los 3 últimos meses >10% | ||
Tabla basada en los artículos originales de Kanga J, Kuhn R, Craigmyle L, Haverstock D, Church D, Cystic Fibrosis Clinical Score: a new scoring system to evaluate acute pulmonary exacerbation, Clin Ther, 1999; 21(8): 1343–56,et al, (1999) and Ramsey BW, Boat TF. Outcome measures for clinical trials in Cystic Fibrosis, Summary of a Cystic fibrosis Foundation Consensus Conference. J Pediatr. 1994; 124(2): 177–92.
Tras la confirmación de EPAICP, los pacientes fueron derivados para hospitalización durante un período de 14 días; recibieron AI, de acuerdo con la sensibilidad detectada mediante el antibiograma2,8. Las técnicas de FTR se aplicaron 2 veces al día durante 30min, un procedimiento sistemático del servicio, estandarizado de acuerdo con la Clinical Guidelines for Physiotherapy Management of Cystic Fibrosis Trust11. Se sometió a Flutter® y percusión a los pacientes de 7–12 años de edad. Para los >12 años de edad, además de las 2 técnicas mencionadas previamente, se usaron técnicas respiratorias de ciclo activo [Active Cycle of Breathing Techniques (ACBT)].
Todos los pacientes recibieron ceftacidima (150mg/kg/día) y amikacina (30mg/kg/día) por vía intravenosa. En presencia de Staphylococcus aureus, el tratamiento se combinó con oxaciclina (200mg/kg/día)2. Durante la hospitalización, se mantuvieron otros procedimientos terapéuticos, como la inhalación de un broncodilatador 3 veces al día, administración de alfadornasa y medidas de soporte nutricional.
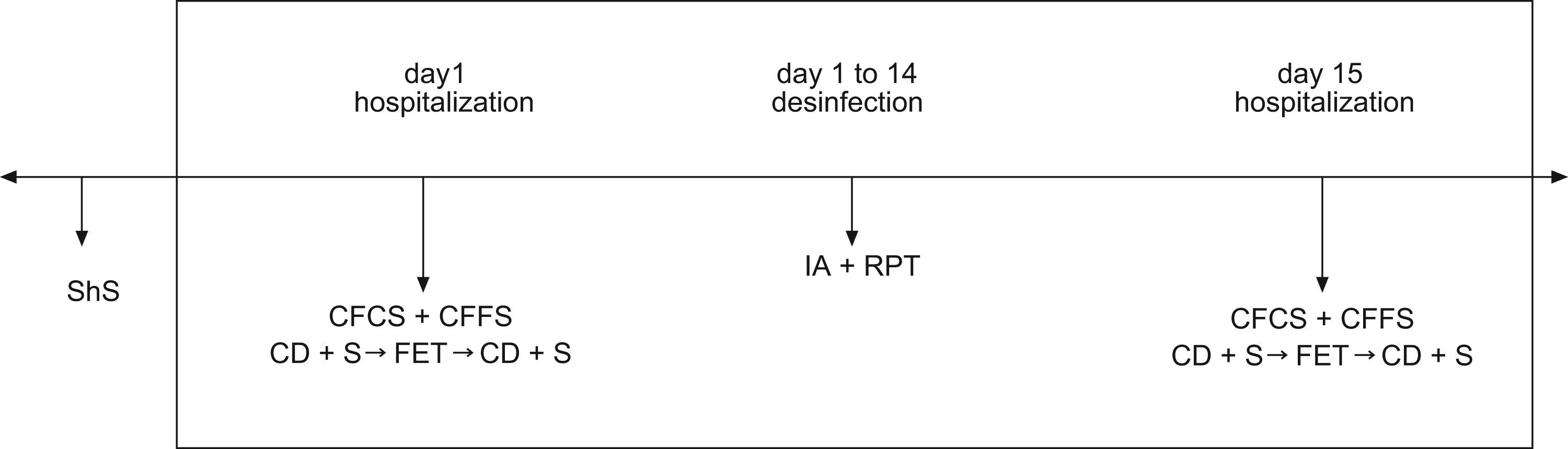
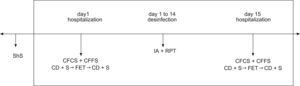
Variables analizadasSegún lo definido en el plan del estudio (fig. 1) en el primer y último día, se analizaron los parámetros espirométricos y otros parámetros (valores de antropometría corporal, parámetros clínicos y puntuaciones).
Plan del estudio.
- 1.
Día 1 de la hospitalización
- 2.
Días 1 a 14 de resolución de la infección
- 3.
Día 15 de hospitalización
- 4.
ShS
- 5.
CFCS + CFFS
- 6.
Datos clínicos + espirometría
Técnica de espiración forzada
Datos clínicos + espirometría
- 7.
AI + fisioterapia respiratoria
- 8.
CFCS + CFFS
- 9.
Datos clínicos + espirometría
Técnica de espiración forzada
Datos clínicos + espirometría
CFCS=Cystic Fibrosis Clinical Score; CFFS=Cystic Fibrosis Foundation Score; FET: técnica de espiración forzada; ShS=puntuación de Shwachman.
Los parámetros clínicos se analizaron inmediatamente después de la CFCS y CFFS. Para su obtención, el paciente permaneció en posición de decúbito prono con un período de reposo de 20min y 10min en posición erguida, destinada a la homogeneización de los valores basales para valorar la FR, FC, saturación de oxígeno de la hemoglobina (SpO2); para estos 2 últimos parámetros, se usó un oxímetro fabricado por OxiPuls Med (Fundação Adib Jatene, São Paulo/Brasil). Tras la obtención de estos parámetros, se efectuó una espirometría de acuerdo con las normas de la American Thoracic Society18. Se utilizó un espirómetro MedGraphic System, modelo CPFS/D (Medical Graphics Corporation, St, Paul/EE.UU.) y, antes del examen, se efectuó un registro del peso, estatura, sexo, edad y etnicidad. Los pacientes llevaron a cabo los exámenes en posición de sedestación y se consideró el mejor de los 3 registros, en un tiempo mínimo de 6 segundos utilizando la misma técnica. Se estudiaron los porcentajes de los valores variables predecibles: capacidad vital forzada (FVC), volumen espiratorio forzado en el primer segundo (FEV1), capacidad vital lenta (SVC), ventilación voluntaria máxima, flujo espiratorio forzado 25–75% (FEF25–75%), flujo espiratorio pico (PEF), capacidad inhalatoria y volumen de reserva espiratorio (ERV). Tras la espirometría, los pacientes se sometieron al procedimiento fisioterápico con TEF. La TEF fue descrita por Webber como una combinación de uno o más «huffs» (una espiración prolongada, forzada, que mantiene la glotis abierta) y períodos de respiración controlada (respiración diafragmática). Se utilizó espiración de baja velocidad con bajos volúmenes pulmonares para contribuir al drenaje de las secreciones por las vías respiratorias distales9,19.
En el presente estudio, el paciente permaneció en sedestación, inspiró profundamente y controló la espiración durante 20min. Las manos del fisioterapeuta siguieron la respiración del paciente sobre cada una de 8 regiones (segmento basilar pulmonar, segmento medial, vértice pulmonar derecho, vértice pulmonar izquierdo, región torácica frontal/esternón, segmento basilar, segmento medial y de nuevo región frontal del tórax), mientras llevaba a cabo las 5 maniobras de espiración forzada con la glotis abierta: los «huffs»; en conjunto, se efectuaron cuarenta maniobras. En el quinto «huff» se solicitó al paciente que tosiera, ayudado por el fisioterapeuta. Acto seguido, el paciente respiró con el diafragma 5 veces (respiración controlada). Cuando estas maniobras concluyeron, el paciente descansó hasta una nueva evaluación.
Los datos espirométricos y clínicos se registraron en 4 momentos diferentes: en el momento de la hospitalización para la AI (antes de TEF1 y después de TEF1) y cuando fueron dados de alta del hospital, tras AI+FTR (antes de TEF2 y después de TEF2).
Se excluyó del estudio a un paciente con dificultades para ejecutar la TEF y la espirometría.
La gravedad de la FQ se clasificó de acuerdo con la puntuación de Shwachman (ShS)16,17, durante las consultas previas a la hospitalización.
Análisis de los datosPara procesar los datos, se usó el programa SPSS, versión 11.0. Para la comparación de las variables de los momentos estudiados, se usó la prueba de Wilcoxon. Para verificar la correlación entre la variación de CFCS y la edad, los parámetros antropométricos corporales y la función pulmonar en el momento de la hospitalización, se utilizó el coeficiente de correlación de Spearman. Para todos los cálculos estadísticos se utilizó un valor de probabilidad de p≤0,05.
El estudio fue aprobado por el comité de investigación de la University of Campinas de Brasil (número 182/2001) y todos los pacientes o sus tutores legales firmaron un formulario de consentimiento informado.
ResultadosSe incluyeron en el estudio 18 pacientes, 10 hombres (55,6%), de 7–28 años de edad (16,1±6,3). La puntuación ShS varió de 30–75 (53,6±12); en 3 pacientes el estado/enfermedad se clasificó como bueno, en 5 como moderado, en nueve como leve y en uno, grave (30 puntos).
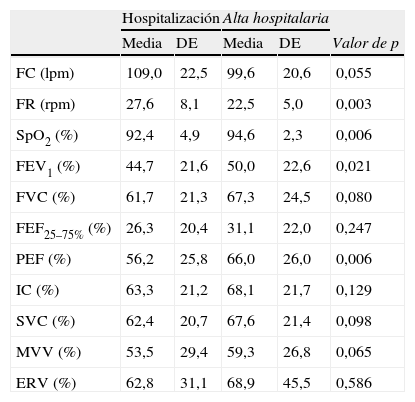
Después del período de AI+FTR, hubo una disminución de la FR media (p=0,003), un aumento de la SpO2 (p=0,006), VEF1 (p=0,021) y PEF (p=0,006). No se observaron diferencias significativas entre los valores predecibles de FVC (p=0,080) y FEF25–75% (p=0,247) (tabla 2).
Media y desviación estándar de los valores de FC, FR SpO2 y parámetros de función pulmonar en la hospitalización y después del alta hospitalaria tras antibioterapia intravenosa y fisioterapia respiratoria
| Hospitalización | Alta hospitalaria | ||||
| Media | DE | Media | DE | Valor de p | |
| FC (lpm) | 109,0 | 22,5 | 99,6 | 20,6 | 0,055 |
| FR (rpm) | 27,6 | 8,1 | 22,5 | 5,0 | 0,003 |
| SpO2 (%) | 92,4 | 4,9 | 94,6 | 2,3 | 0,006 |
| FEV1 (%) | 44,7 | 21,6 | 50,0 | 22,6 | 0,021 |
| FVC (%) | 61,7 | 21,3 | 67,3 | 24,5 | 0,080 |
| FEF25–75% (%) | 26,3 | 20,4 | 31,1 | 22,0 | 0,247 |
| PEF (%) | 56,2 | 25,8 | 66,0 | 26,0 | 0,006 |
| IC (%) | 63,3 | 21,2 | 68,1 | 21,7 | 0,129 |
| SVC (%) | 62,4 | 20,7 | 67,6 | 21,4 | 0,098 |
| MVV (%) | 53,5 | 29,4 | 59,3 | 26,8 | 0,065 |
| ERV (%) | 62,8 | 31,1 | 68,9 | 45,5 | 0,586 |
ERV: volumen de reserva espiratoria; FEF25–75%:flujo espiratorio forzado 25–75%; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IC: capacidad de inhalación; MVV: ventilación voluntaria máxima; p: probabilidad de la prueba de Wilcoxon; PEF: flujo espiratorio pico; SpO2: saturación de oxígeno; SVC: capacidad vital lenta; (%), porcentaje predecible.
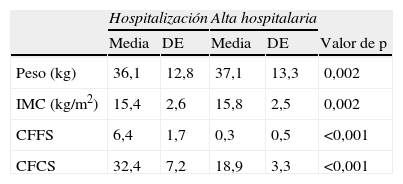
Durante el período AI+FTR, el peso medio aumentó desde 36,1 a 37,1kg (p=0,002) y el IMC medio aumentó desde 15,4±2,6 a 15,8±2,5 (p=0,002) (tabla 3).
Media y desviación estándar del peso corporal y el IMC y puntuaciones de exacerbación en la hospitalización y después del alta hospitalaria tras antibioterapia intravenosa y fisioterapia respiratoria
| Hospitalización | Alta hospitalaria | ||||
| Media | DE | Media | DE | Valor de p | |
| Peso (kg) | 36,1 | 12,8 | 37,1 | 13,3 | 0,002 |
| IMC (kg/m2) | 15,4 | 2,6 | 15,8 | 2,5 | 0,002 |
| CFFS | 6,4 | 1,7 | 0,3 | 0,5 | <0,001 |
| CFCS | 32,4 | 7,2 | 18,9 | 3,3 | <0,001 |
CFCS: Cystic Fibrosis Clinical Score; CFFS: Cystic Fibrosis Foundation Score; p: probabilidad de la prueba de Wilcoxon; (%): porcentaje predecible.
La puntuación de exacerbación CFCS fue de 32,4±7,2 (22,0 a 49,0) y, en el momento del alta hospitalaria, fue de 18,9±3,3 (12,0 a 24,0) (p<0,001). La diferencia media entre ambos períodos fue de 13,5±6,3 (tabla 3). Se observó una reducción significativa de la puntuación CFFS (p<0,001).
No se observó una correlación entre la variación de CFCS y la edad (p=0,550): (p=0,686), IMC (p=0,459), SpO2 (p=0,231), FEV1 (p=0,160), FVC (p=0,438) y ShS (p=0,337).
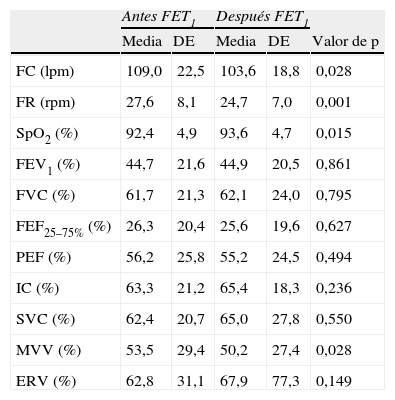
En el momento de la hospitalización, en los pacientes sometidos a TEF se identificó un aumento estadísticamente significativo de SpO2 (p=0,015) y una reducción de FR y FC (p=0,001 y p=0,028). No obstante, hubo una reducción significativa de ventilación voluntaria máxima, del 53,5% del valor predecible al 50,2% (p=0,028) (tabla 4).
Media y desviación estándar de la FC, FR, SpO2 y parámetros de función pulmonar en antes (antes de TEF1) y después de TEF (después de TEF2) en la hospitalización para antibioterapia intravenosa y fisioterapia respiratoria
| Antes FET1 | Después FET1 | ||||
| Media | DE | Media | DE | Valor de p | |
| FC (lpm) | 109,0 | 22,5 | 103,6 | 18,8 | 0,028 |
| FR (rpm) | 27,6 | 8,1 | 24,7 | 7,0 | 0,001 |
| SpO2 (%) | 92,4 | 4,9 | 93,6 | 4,7 | 0,015 |
| FEV1 (%) | 44,7 | 21,6 | 44,9 | 20,5 | 0,861 |
| FVC (%) | 61,7 | 21,3 | 62,1 | 24,0 | 0,795 |
| FEF25–75% (%) | 26,3 | 20,4 | 25,6 | 19,6 | 0,627 |
| PEF (%) | 56,2 | 25,8 | 55,2 | 24,5 | 0,494 |
| IC (%) | 63,3 | 21,2 | 65,4 | 18,3 | 0,236 |
| SVC (%) | 62,4 | 20,7 | 65,0 | 27,8 | 0,550 |
| MVV (%) | 53,5 | 29,4 | 50,2 | 27,4 | 0,028 |
| ERV (%) | 62,8 | 31,1 | 67,9 | 77,3 | 0,149 |
ERV: volumen de reserva espiratoria; FEF25–75%:flujo espiratorio forzado 25–75%; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IC: capacidad de inhalación; MVV: ventilación voluntaria máxima; p: probabilidad de la prueba de Wilcoxon; PEF: flujo espiratorio pico; SpO2: saturación de oxígeno; SVC: capacidad vital lenta; (%): porcentaje predecible.
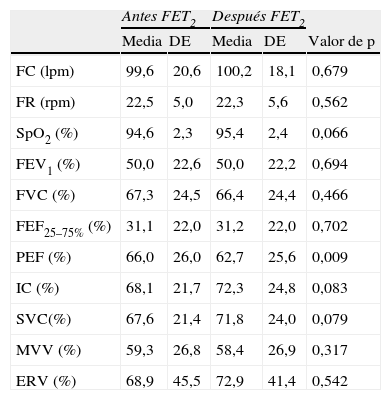
El efecto inmediato de la TEF sobre los parámetros espirométricos y cardiorrespiratorios en el momento del alta hospitalaria se presenta en la tabla 5. Inmediatamente después de TEF, hubo una reducción significativa de los valores de PEF (p=0,009) y ninguna otra variable experimentó alteraciones.
Media y desviación estándar de los valores de FC, FR, SpO2 y parámetros de función pulmonar antes (antes de TEF2) y después de TEF (después de TEF2) en el momento del alta hospitalaria tras antibioterapia intravenosa y fisioterapia respiratoria
| Antes FET2 | Después FET2 | ||||
| Media | DE | Media | DE | Valor de p | |
| FC (lpm) | 99,6 | 20,6 | 100,2 | 18,1 | 0,679 |
| FR (rpm) | 22,5 | 5,0 | 22,3 | 5,6 | 0,562 |
| SpO2 (%) | 94,6 | 2,3 | 95,4 | 2,4 | 0,066 |
| FEV1 (%) | 50,0 | 22,6 | 50,0 | 22,2 | 0,694 |
| FVC (%) | 67,3 | 24,5 | 66,4 | 24,4 | 0,466 |
| FEF25–75% (%) | 31,1 | 22,0 | 31,2 | 22,0 | 0,702 |
| PEF (%) | 66,0 | 26,0 | 62,7 | 25,6 | 0,009 |
| IC (%) | 68,1 | 21,7 | 72,3 | 24,8 | 0,083 |
| SVC(%) | 67,6 | 21,4 | 71,8 | 24,0 | 0,079 |
| MVV (%) | 59,3 | 26,8 | 58,4 | 26,9 | 0,317 |
| ERV (%) | 68,9 | 45,5 | 72,9 | 41,4 | 0,542 |
ERV: volumen de reserva espiratoria; FEF25–75%: flujo espiratorio forzado 25–75%; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IC: capacidad de inhalación; MVV: ventilación voluntaria máxima; p: probabilidad de la prueba de Wilcoxon; PEF: flujo espiratorio pico; SpO2: saturación de oxígeno; SVC: capacidad vital lenta; (%), porcentaje predecible.
En el presente estudio se investigó el efecto de la TEF en pacientes con fibrosis quística, antes y después del tratamiento de EPAICP, y reveló la eficacia de esta técnica en el momento de la hospitalización. El presente estudio también corrobora los efectos positivos de la combinación de AI y FTR para estos casos.
El tratamiento de la EPAICP plantea importantes problemas: el momento exacto de iniciar el tratamiento, la medicación que debe prescribirse; si deben administrarse combinaciones terapéuticas; y si debe administrarse de forma sistemática antes de que debute la EPAICP.
En nuestro servicio, los pacientes con este proceso son hospitalizados y sometidos a una combinación de AI+FTR durante 14 días. El presente estudio demostró que este tratamiento mejoró sustancialmente la función pulmonar, los parámetros de antropometría corporal, parámetros cardiorrespiratorios y puntuaciones de exacerbación pulmonar.
Los valores medios de las variables espirométricas de los pacientes estudiados (FEV1: 44,7% y FVC: 61,7%) demostraron una afectación leve en el momento de la inclusión. En comparación con otros estudios que han evaluado los efectos de la AI y FTR, en la muestra de pacientes del presente estudio se evidenció una enfermedad más grave7,20–22.
La mejora significativa de los valores de FEV1 y PEF indica que el tratamiento AI+FTR fue eficaz para el aclaramiento de las vías respiratorias de pacientes con EPAICP, aunque no pueda determinarse el efecto individual de AI y de FTR sobre la espirometría.
En diversos estudios se ha descrito una mejora de la función pulmonar con AI2,4,7,8,22,23. Aunque la espirometría suele usarse para esta valoración, en los estudios efectuados, se sugiere que el FEV1 es el principal marcador7,12,15,21. Su reproducibilidad, elevada correlación con la mortalidad, contribución a la indicación de trasplante pulmonar y aplicabilidad en la investigación de los efectos de los diferentes tratamientos, representan algunos de los argumentos para usar este parámetro15,16,18. También se ha demostrado que otros métodos, como la técnica de oscilación forzada, son una alternativa para valorar la función pulmonar después de AI para EPAICP21.
La AI reduce la inflamación y la obstrucción de las vías inflamatorias en pacientes con fibrosis quística2,8,15. Los autores sugieren que la eficiencia de la AI se potencia cuando se combina con FTR intensificada durante la hospitalización20,23,24, de preferencia antes de la administración de antibiótico2,8. Sin embargo, en esta situación nunca se han valorado los efectos aislados de la AI y la FTR. Se está efectuando un examen de cribado ético de un modelo para examinar el papel de cada una por separado. El paciente FQ ingresado para el tratamiento de una exacerbación pulmonar requiere los servicios proveídos en general por el fisioterapeuta respiratorio, incluida la administración de fármacos nebulizados (antibióticos, dornasa alfa, broncodilatadores, suero salino hipertónico, realización de la FTR, provisión de oxígeno suplementario e inicio del tratamiento de soporte con ventilación mecánica no invasiva e invasiva). Debido a todo esto, un importante aspecto de la hospitalización es la interacción entre el fisioterapeuta y el paciente. Siguiendo las recomendaciones de las guías de FQ pulmonar, también proporcionan formación e información al paciente y a su familia15.
Recientemente, Prasad y cols. y Homnick describieron la dificultad de aislar los efectos de la FTR y el efecto de una estrategia terapéutica multidisciplinaria (nutrición y tratamiento inhalatorio)1,19. Esto es aún más difícil durante la hospitalización para la resolución de la infección ya que participan factores como el reposo y la AI8,24,25.
Un estudio individual con implicaciones metodológicas trató de aislar el efecto de la FTR en la pauta terapéutica para la EPAICP. Oberwalder et al (1991) llevaron a cabo pruebas de función pulmonar inmediatamente después de maniobras de presión espiratoria positiva de las vías respiratorias más TEF en 4 momentos diferentes: en el momento de la hospitalización, y en los días 5, 10 y 15. Observaron un aumento progresivo de los parámetros de función pulmonar después de la fisioterapia, que atribuyeron al efecto acumulativo de esta durante la hospitalización24.
Los cambios del volumen pulmonar han sido pertinentes clínicamente en la valoración de pacientes con enfermedad pulmonar obstructiva crónica después de la prueba broncodilatadora, en comparación con FEV1 y FVC26. Considerando este concepto, la evaluación de los volúmenes determinados para la capacidad vital lenta mediante espirometría podría representar una alternativa a la evaluación del efecto de la FTR en la fibrosis quística, ya que los métodos usados son controvertidos9–12. En el presente estudio, la asociación de AI+FTR, al igual que la TEF aislada, no dio lugar a una mejora de los parámetros relacionados con las determinaciones del volumen pulmonar (capacidad inhalatoria y VC), aunque hubo una disminución de la FR con AI más FTR y después de TEF durante la hospitalización. El aumento del volumen pulmonar favorece la disminución de los ciclos inspiratorios, lo que garantiza una ventilación adecuada y mantiene el intercambio de gases. Por lo tanto, se formula la hipótesis de que una mejora del volumen podría relacionarse con una mejoría de FR y SpO2.
Encontramos una disminución de la FC, FR y un aumento de SpO2 inmediatamente después de la TEF y también después de AI+FTR, que pone de relieve el efecto positivo de la fisioterapia respiratoria sobre los parámetros cardiorrespiratorios. El mismo resultado se documentó en un estudio en el que se usó el ciclo activo de las técnicas respiratorias (Active Cycle of Breathing Techniques), donde el principal componente fue la TEF20.
La utilización de valoraciones de SpO2 como marcador del efecto de la FTR se considera accesible, fácil de aplicar y de bajo coste. Sin embargo, al contrario que en el presente estudio, en pocas investigaciones se han obtenido resultados coherentes utilizando este parámetro19. El resultado del presente estudio podría guardar relación con la gravedad del estado clínico de los pacientes, al igual que la elección de una FTR determinada con un menor número de efectos adversos. El hecho de que la TEF no desencadene hipoxemia, broncoespasmo y reflujo gastroesofágico, como sucede con la aplicación de las técnicas convencionales7,19,25, contribuye a la indicación de este método, principalmente en individuos con EPAICP.
Aunque en estos momentos no se dispone de un marcador con una sensibilidad y especificidad apropiadas para valorar los efectos de la FTR10,12,25, la valoración de la FR, FC y SpO2 parece constituir un marcador apropiado de las técnicas de aclaramiento de las vías respiratorias, como la TEF. Observamos que los 3 parámetros se comportan de forma similar, lo que sugiere que el efecto de aclaramiento de la técnica favorece una mejora de la ventilación y oxigenación, con la consiguiente disminución del esfuerzo para respirar.
Tras la AI+FTR, también se observó un cambio significativo de las puntuaciones de exacerbación, CFCS y CFFS. La aplicación de estas puntuaciones clínicas en la fibrosis quística se ha adoptado por diversas razones: evaluación de la gravedad de la enfermedad, predicción de su evolución, identificación de las exacerbaciones pulmonares, y seguimiento de la respuesta al tratamiento13,14. En el presente estudio, las alteraciones fueron muy significativas, ya que los valores de ambas puntuaciones revelaron una mejora clínica y del estado general de los pacientes tras la hospitalización; el estudio respalda la consideración de que se obtenga un consenso en las guías de tratamiento de la fibrosis quística2,3,15,26.
Durante el análisis de correlación, no observamos variables correlacionadas con una mejora de CFCS. Esto indica que, con independencia de la edad, gravedad de la enfermedad, valores del flujo espiratorio y parámetros de antropometría corporal en el momento de la hospitalización, en todos los pacientes, se obtuvo una mejoría con AI+FTR.
Muchos estudios han investigado los efectos de una mejoría de la nutrición sobre la función pulmonar, y viceversa. En el presente estudio, además de la mejoría ya mencionada de la función pulmonar, la combinación de AI+FTR favoreció un aumento del peso y del IMC del paciente. Algunos autores han evaluado el gasto energético de pacientes con fibrosis quística6,27,28. En pocas investigaciones se ha identificado una influencia sustancial del estado respiratorio en los componentes nutricionales, sobre todo en situaciones de exacerbación pulmonar aguda. La AI parece moderar el gasto energético basal de los pacientes6,8,28, lo que explicaría la mejoría del peso y del IMC identificada en el presente estudio. El cambio del peso corporal se relacionó con el tratamiento de soporte nutricional ofrecido durante la hospitalización.
En ninguno de los 2 momentos en los que se aplicó TEF se detectó una mejoría inmediata de los valores de la espirometría. Se observó una reducción significativa de ventilación voluntaria máxima de pacientes con EPAICP tras someterse a TEF. Esta reducción se debió al hecho de que la maniobra requiere un esfuerzo muscular y la técnica se efectúa en una situación de obstrucción bronquial, disnea y poco después de episodios de tos como consecuencia de los procedimientos de fisioterapia. Además del agotamiento sustancial del paciente, la reducción de esta variable también podría asociarse a una hiperinsuflación dinámica inmediatamente después de la TEF. Este acontecimiento se presenta durante el ejercicio/esfuerzo, cuando la limitación del flujo respiratorio produce respiraciones de alto volumen pulmonar26, lo que aumenta el trabajo elástico y favorece la hiperinsuflación. En unos pocos estudios, que han comparado el efecto de la FTR convencional y la TEF sobre el FEV1, se ha identificado un mayor efecto de aclaramiento de las vías respiratorias con los tratamientos convencionales, o ninguna diferencia entre ellos7,12. Con la aplicación de TEF asociada a drenaje postural se observó una mayor expectoración y mejora de los valores de FEV19–12,25. En estos estudios no se estandarizó la aplicación de TEF, no incluyeron un grupo de control y se asociaron a problemas metodológicos, lo que ha suscitado críticas constantes en artículos y revisiones de publicación reciente.
La TEF se introdujo en la fisoterapia con el objetivo de reducir a un mínimo el estrés característico inducido por las técnicas convencionales y para obtener un aclaramiento de las secreciones bronquiales9,11. La técnica está indicada en el caso de exacerbaciones agudas. Durante los 10 últimos años, la inclusión de TEF en la FTR se ha reconocido como un importante avance en el tratamiento fisioterápico9–11. Además, en el tratamiento de pacientes con bronquiectasias, al igual que en la fibrosis quística, Vendrell y cols. recomiendan la aplicación de FTR en autotratamiento, lo que facilita la adhesión a largo plazo8.
En la EPAICP, las vías respiratorias están inflamadas, u obstruidas, con descamación epitelial, inestabilidad e hiperreactividad. Durante la maniobra de espiración forzada, como en la maniobra de espirometría, la tos, y la FTR, estas características de las vías respiratorias pueden exacerbarse, lo que potencia la tendencia al colapso29,30. Por lo tanto, la aplicación de TEF no se acompañaría de resultados espirométricos positivos aunque sus efectos sobre el aclaramiento se hacen evidentes a través de una mejora sustancial de los parámetros cardiorrespiratorios evaluados.
Puesto que la TEF es una técnica de aclaramiento de las vías respiratorias, la aplicación de la maniobra tras resolución de la infección redujo el PEF, lo que atribuimos a la ausencia de secreciones en las vías respiratorias y al esfuerzo inducido por la maniobra espirométrica de espiración forzada30.
Se ha descrito la dificultad para adecuar el tamaño de la muestra en los estudios para valorar los efectos de la FTR en la fibrosis quística25. Los autores del presente estudio reconocen la limitación de la muestra, aunque en los estudios recientes sobre FTR y AI5,21 se describió una casuística similar (16 y 14, respectivamente). En la actualidad, con los conocimientos y guías bien definidas y establecidas para la EPAICP, pueden aparecer muchos estudios multicéntricos con un tamaño calculado de la muestra, para verificar con mayor precisión estadística la hipótesis descrita. Otra limitación del presente estudio fue que no consideró un parámetro de evaluación la recidiva y gravedad de los episodios de exacerbación de pacientes con FQ sometidos al protocolo del tratamiento presentado. Los autores sugieren que este es un futuro objetivo del estudio sobre AI y FTR, dada la pertinencia clínica del número de hospitalizaciones y su calidad para la elaboración terapéutica de métodos en el tratamiento de la enfermedad.
Aunque la fisioterapia respiratoria es un tratamiento adyuvante de otras intervenciones terapéuticas en la fibrosis quística, al igual que la AI, todavía es motivo de controversia la técnica y las estandarizaciones ideales, al igual que los parámetros más apropiados para la evaluación de sus efectos y el momento más adecuado para su aplicación.
ConclusiónEl presente estudio reveló el efecto de la AI+FTR sobre las puntuaciones, parámetros cardiorrespiratorios, nutricionales y espirométricos y evidenció una mejora clínica en pacientes con EPAICP. El efecto positivo de la TEF se observó en el momento de la hospitalización, probablemente debido al importante componente obstructivo en esta situación.