Introducción
En los últimos años se ha demostrado que enfermedades que se suponía exclusivamente pulmonares o bronquiales suelen asociarse a afección nasal y paranasal. El concepto de rinobronquitis1 ha suscitado la idea de que las vías respiratorias superior e inferior constituyen una única vía, con una enfermedad común que afecta a todo el aparato respiratorio. Esto se ha demostrado y confirmado en múltiples estudios epidemiológicos, con lo que ha aparecido el concepto de "una única vía, una única enfermedad" (fig. 1). El ejemplo más claro de dicha asociación es la rinitis y el asma2, pues se ha demostrado que ambas se dan de forma conjunta en la mayoría de los asmáticos y que el tratamiento de la rinitis puede tener efectos beneficiosos en el curso del asma3.
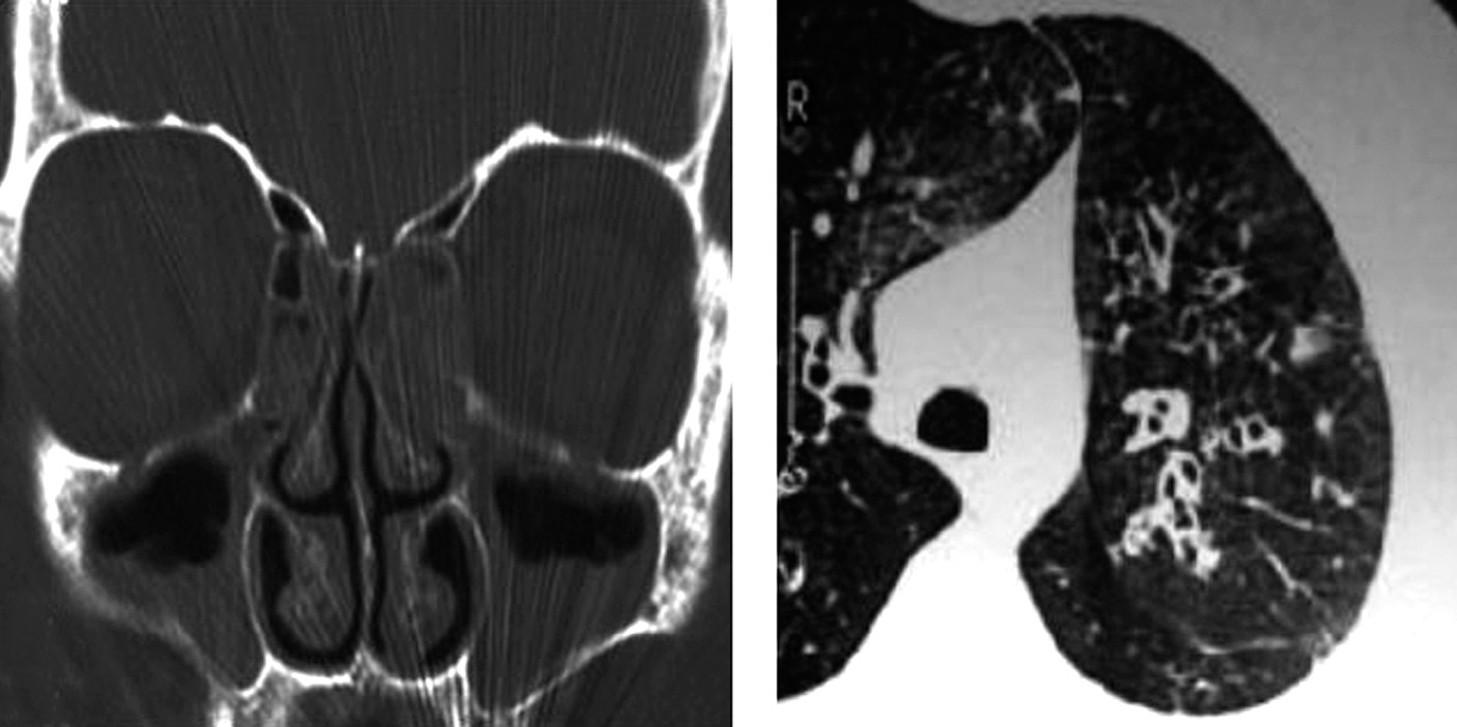
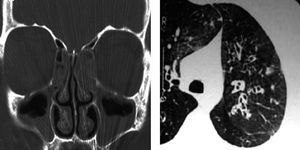
Fig. 1. Rinosinusopatía crónica en la región maxiloetmoidal bilateral (tomografía axial computarizada de senos) junto a bronquiectasias bilaterales (tomografía pulmonar) en un mismo paciente.
Las vías respiratorias superiores e inferiores tienen como función común la de acondicionar y canalizar el aire del exterior al interior de los pulmones. Dentro de esta función común existen unas funciones especializadas propias de las diferentes áreas que la forman: humidificación, calentamiento, filtración, fonación e intercambio gaseoso4.
Mucosas nasal y bronquial
Las mucosas nasal y bronquial tienen una estructura similar en el epitelio y la lámina propia. Una de las funciones más importantes de la nariz es actuar como barrera para evitar la inhalación de sustancias nocivas tanto infecciosas como de naturaleza no infecciosa. La nariz actúa, además, como acondicionador del aire respirado calentándolo y humidificándolo. La función que más diferencia la nariz de las vías aéreas inferiores es sin duda la olfativa, que le es propia y tiene su base en la pituitaria, situada en el techo de la fosa nasal5.
El epitelio escamoso que se encuentra en la válvula nasal se transforma en el resto de la nariz en un epitelio respiratorio columnar ciliado seudoestratificado. En la nariz dicho epitelio columnar está formado por células ciliadas, células no ciliadas, células basales, células caliciformes o goblet, y se diferencia del epitelio respiratorio bajo porque no existen células serosas, células de Clara y células en cepillo6. La membrana basal está compuesta por colágeno tipo IV, proteoglucanos, laminina y fibronectina. Debajo de ésta existe la denominada lamina reticularis, que se encuentra engrosada de manera difusa en los pacientes asmáticos7. Se observan engrosamientos focales de dicha membrana en los pacientes afectados de bronquiectasias, tuberculosis y rinosinusitis crónica8. En los pacientes con rinitis no se han detectado cambios en esta zona9.
En la submucosa hay glándulas, vasos sanguíneos, nervios, células extravasculares y matriz extracelular. Una de las grandes diferencias se encuentran aquí, ya que el músculo liso se halla en la capa submucosa del bronquio, pero no en la submucosa de la nariz6.
En la nariz predominan las glándulas y los vasos. Aparte de los vasos arteriales, la vascularización nasal está formada por lechos capilares, cortocircuitos arteriovenosos, sinusoides y vasos venosos. Las venas que drenan los sinusoides contienen músculo liso. Cuando dichas venas se contraen, se produce una expansión de los sinusoides, por lo que se incrementa el tamaño de los cornetes (tejido eréctil) y se refleja en los flujos nasales. Esto no sucede en los bronquios, donde los cambios de resistencia al flujo se deben a la contracción de la musculatura lisa.
Transporte mucociliar
El aparato mucociliar está formado por los numerosos cilios que emergen de la superficie de las células epiteliales columnares seudoestratificadas. Cada célula ciliada contiene alrededor de 200-300 cilios que realizan unas 500 batidas por minuto. La frecuencia de batidas disminuye distalmente10, de modo que en las vías medias la frecuencia es menor. Su alteración en esta zona puede conducir al estancamiento de secreciones y predisposición a padecer infecciones locales, lo que posiblemente contribuya al desarrollo de bronquiectasias en esa parte de las vías respiratorias11. El defecto en la ultraestructura de los cilios, que altera y evita su normal motilidad, predispone a las infecciones crónicas y recurrentes (rinosinusitis crónica), infecciones pulmonares que provocan la aparición de bronquiectasias.
Aproximadamente, el 70-80% de los asmáticos presentan rinitis y, según estudios recientes, la rinitis es un factor que predispone al desarrollo ulterior de asma12. Este hecho ha llevado a la realización de estudios con finalidad preventiva dirigidos a tratar precozmente la rinitis para evitar el asma.
La poliposis nasal se detecta en el 2-4% de la población, mientras que en los pacientes asmáticos la prevalencia llega al 7%. En quienes padecen asma leve es poco habitual encontrar poliposis; a medida que aumenta la gravedad de la enfermedad, aparecen sinusopatía y poliposis nasal con mucha mayor frecuencia, hasta el punto de que es excepcional que entre los pacientes con asma e intolerancia a la aspirina no se observe poliposis nasal13.
También se ha observado que existe relación entre la enfermedad pulmonar obstructiva crónica (EPOC) y la rinitis14, pues en las biopsias de mucosa nasal de los individuos con EPOC se han apreciado alteraciones inflamatorias similares a las halladas en las biopsias bronquiales de estos mismos pacientes15.
La asociación de la rinorrea anterior y posterior, de los estornudos, de la congestión nasal y de la pérdida del olfato con los síntomas respiratorios induce asimismo a pensar en la relación entre las vías respiratorias altas y bajas16.
Bronquiectasias
La bronquiectasia es la destrucción y dilatación anormal, permanente e irreversible de uno o más bronquios medianos y pequeños (de la cuarta a la novena generación), producida, por destrucción de los componentes musculares y elásticos de la pared bronquial. Se ignora cuál es su prevalencia en la población general y tampoco se conoce bien la historia natural de la enfermedad, ya que no se han realizado estudios desde el inicio del proceso y con posterior análisis de su evolución17.
Laennec18 (1819) fue quien describió la bronquiectasia y señaló que se debía a la retención de secreciones bronquiales con destrucción secundaria de la pared y posterior debilitamiento y dilatación de la misma. Esta interpretación es aún válida y se considera que la inflamación bronquial desempeña un papel central. En 1922, con la introducción de la broncografía con contraste por Sicard, se pudo observar con mejor precisión la imagen de las bronquiectasias19.
Etiopatogenia
La bronquiectasia no es en sí misma una única enfermedad, sino que puede ser el resultado de diversas enfermedades que lesionan la pared bronquial e interfieren así en sus defensas, ya sea de forma directa o indirecta. La afección puede ser difusa o local. Es típica la dilatación de los bronquios de tamaño medio, pero a menudo los bronquios pequeños también presentan engrosamiento u obliteración. En las bronquiectasias se encuentran áreas de la pared bronquial destruidas e inflamadas crónicamente; las células ciliadas están dañadas o destruidas y la producción de moco está aumentada, con lo que se pierde el tono normal de la pared. El aumento de la producción de moco facilita el crecimiento de las bacterias, obstruye los bronquios y favorece el estancamiento de las secreciones infectadas, con lesión posterior de la pared bronquial20. La inflamación puede extenderse a los alveolos y producir bronconeumonía, formación de tejido cicatrizal y pérdida del tejido pulmonar sano. Además, la inflamación de los vasos sanguíneos de la pared bronquial puede ocasionar expectoración hemoptoica o hemoptisis franca. En el examen anatomopatológico se observan dilataciones bronquiales, hipertrofia de la mucosa, en ocasiones con metaplasia escamosa, infiltrado linfocitario de la pared bronquial y desaparición de cartílago, músculo y fibras elásticas, que son sustituidas por tejido cicatrizal21.
Las bronquiectasias localizadas suelen estar motivadas por estenosis de algún bronquio debido a procesos inflamatorios, neoformativos o cuerpos extraños22. Cualquier circunstancia que produzca colapso por absorción en la zona y fibrosis del tejido pulmonar adyacente contribuye a la formación de bronquiectasias por dilatación compensadora del bronquio.
Las bronquiectasias difusas pueden deberse a múltiples causas (tabla I), entre las que destacan las enfermedades congénitas que afectan a la función mucociliar, como son la fibrosis quística o las discinesias (síndrome de Kartagener, síndrome de Young). En otras ocasiones se asocian a defectos en los mecanismos de defensa que favorecen el desarrollo de infecciones bronquiales repetidas (inmunodeficiencia común variable, deficiencias de la formación de anticuerpos). Algunas bronquiectasias parecen haberse desarrollado a raíz de una bronquiolitis infecciosa en la infancia (sarampión, virus respiratorio sincitial). También pueden presentarse aso- ciadas a enfermedades sistémicas (artritis reumatoide, síndrome de Sjögren) o a enfermedades inflamatorias intestinales (colitis ulcerosa, enfermedad de Crohn). En un número reducido de casos pueden ser la consecuencia de la aspiración de sustancias tóxicas que lesionan los bronquios.
Según su forma, existen 3 tipos de bronquiectasias: cilíndricas, varicosas y saculares (las 2 últimas suelen ser las más graves clínicamente).
La biopsia de la mucosa bronquial revela la infiltración por neutrófilos y linfocitos T21, además de un aumento del contenido de elastasa en el esputo23 y un incremento de las concentraciones de interleucina 824, factor de necrosis tumoral alfa25 y prostanoides26.
La complicación más frecuente de las bronquiectasias es la sobreinfección27. La colonización más frecuente en estos pacientes es por Haemophilus influenzae (55%) y Pseudomonas spp. (26%)28. Menos frecuentes son el desarrollo de abscesos metastásicos de predomino en el sistema nervioso central (12-16%) y las acumulaciones de amiloide tipo AA (6%). Otras complicaciones son la hipertensión pulmonar y el cor pulmonale crónico. En las bronquiectasias saculares es más frecuente encontrar los dedos en palillo de tambor.
Clínica
A pesar de que las bronquiectasias pueden producirse a cualquier edad, la enfermedad se inicia con mayor frecuencia en las primeras 2 décadas de la vida. Dado que los síntomas pueden no manifestarse hasta mucho más tarde o incluso nunca, en algunas ocasiones se realiza el diagnóstico radiológico cuando las bronquiectasias aún son asintomáticas. La clínica más frecuente suele consistir en tos con expectoración abundante (broncorrea) y ocasionalmente hemoptoica. La cantidad y el tipo de esputo dependen de lo extensa que sea la enfermedad y de la presencia de una infección activa. En algunas ocasiones puede producirse hemoptisis masiva. Las neumo-nías son relativamente frecuentes y en algunos casos se presentan de forma repetida. Las bronquiectasias extensas pueden llegar a ocasionar insuficiencia respiratoria, hipertensión pulmonar y cor pulmonale29.
Diagnóstico
El diagnóstico se realiza por historia clínica y radiología. La radiografía simple de tórax puede mostrar imágenes muy indicativas de bronquiectasias como las denominadas en "raíl de tren", quistes y bronquios rellenos de moco (imagen en dedos de guante), aunque lo más frecuente es que sea normal o muestre cambios inespecíficos como el aumento de las marcas broncovasculares. Hoy día, la tomografía axial computarizada (TAC) de tórax permite diagnosticar la enfermedad con certeza al tiempo que evalúa su localización y extensión30. La broncografía, técnica usada en el diagnóstico antes de la introducción de la TAC, ya no se utiliza.
El examen de la función pulmonar puede mostrar un patrón obstructivo de grado diverso según la extensión de la enfermedad, aunque no es infrecuente observar patrones mixtos ocasionados por la frecuente pérdida de volumen por colapso de algunos lóbulos asociada a la obstrucción. El intercambio de gases puede estar muy alterado debido a la presencia de zonas de cortocircuito que causan en ocasiones hipoxemia acentuada31.
Tratamiento
El objetivo principal del tratamiento es controlar las infecciones y las secreciones, evitando la obstrucción de las vías aéreas y sus complicaciones. Es fundamental la fisioterapia respiratoria efectiva, con el fin de expulsar las secreciones bronquiales. La disminución de algunas infecciones virales en la infancia gracias a la vacunación ha permitido reducir el riesgo de desarrollar bronquiectasias. La vacunación contra el neumococo y Haemophilus y la vacunación anual contra el virus de la gripe contribuyen muy probablemente a disminuir el número de episodios infecciosos graves32.
Enfermedades que ocasionan bronquiectasias y afección nasal asociada
Fibrosis quística
La fibrosis quística (FQ) es la alteración genética de tipo autosómico recesivo más común en la población caucásica. Uno de cada 25 individuos es portador del gen33,34. Se calcula que afecta aproximadamente a uno de cada 3.000-10.000 nacidos vivos por año. El gen responsable de la FQ se encuentra en el locus simple del brazo largo del cromosoma 7. La deleción de 3 pares de bases o mutación delta F508 acontece aproximadamente en el 70% de todos los cromosomas de la FQ. La proteína defectuosa codificada por este gen anormal tiene una estructura similar a la de una clase de proteínas conocidas por ser activas en el transporte epitelial y se ha denominado CFTR (cystic fibrosis transmembrane regulator)35. Esta proteína defectuosa contribuye al mal funcionamiento de los canales del cloro, lo cual provoca un aumento de la viscosidad del moco que dificulta su eliminación y favorece la colonización por Staphylococcus aureus y Pseudomonas mucoide.
Se han identificado muchas otras mutaciones cerca del locus afectado. Los pacientes con FQ se caracterizan por presentar infecciones repetidas en el tracto respiratorio, insuficiencia pancreática exocrina e infertilidad. En estadios tempranos la radiografía de tórax36 muestra afectación de los lóbulos superiores, que se vuelven difusos con la progresión de la enfermedad. La función pulmonar puede ser normal o presentar un patrón de tipo obstructivo o mixto. En la presentación adulta de la enfermedad, los síntomas normalmente han estado presentes durante años, pero muchas veces no se tienen en cuenta al ser moderados. El adulto puede presentar bronquiectasias, rinosinusitis, insuficiencia pancreática, pancreatitis aguda, colelitiasis e infertilidad. La obstrucción nasal es el síntoma más frecuente entre los pacientes con FQ. La incidencia de poliposis nasal es de más del 20% de los pacientes. Hay diferentes patrones de rinosinusitis: pólipos nasales, rinosinusitis crónica purulenta y mucopiosinusitis del antro del seno maxilar con protrusión de la pared nasal lateral37. Esta última entidad recibe el nombre de seudomucocele maxilar. En el diagnóstico de la FQ es importante la prueba del sudor38 (las concentraciones de sodio o cloro son de 60 mmol/l, mientras que en individuos sanos y portadores del gen de la FQ son de 30 mmol/l), el estudio genotípico y la TAC pulmonar y sinusal. Los objetivos del tratamiento son: reducir la obstrucción, controlar las infecciones39, disminuir la inflamación y mejorar el estado nutricional. El tratamiento nasal consiste en lavados con suero fisiológico, corticoterapia intranasal, antibioterapia y, en caso necesario, cirugía endoscópica funcional de senos.
Discinesia ciliar primaria
La discinesia ciliar primaria (DCP) es una enfermedad congénita en la que existe una alteración total o parcial de la función de las células ciliadas40. Es una enfermedad autosómica recesiva que afecta a uno de cada 16.000 nacidos vivos y se presenta clínicamente con rinosinusitis, bronquiectasias y, de forma menos frecuente, esterilidad en los varones. En el síndrome de discinesia (dificultad para el movimiento) ciliar primaria existen alteraciones estructurales o funcionales en los microtúbulos de los cilios que son responsables del movimiento de éstos. Tales alteraciones originan un mal aclaramiento del moco de los cilios, con las consiguientes infecciones bronquiales supurativas y bronquiectasias. Se alteran todas las estructuras donde existen cilios: epitelios de las vías respiratorias, senos paranasales, trompa de Eustaquio y espermatozoides (astenospermia)41.
El 50% de los individuos afectados presenta síndrome de Kartagener, que se caracteriza por la tríada de bronquiectasias, rinosinusitis crónica y situs inversus (dextrocardia)42,43. La rinitis con presencia de rinorrea anterior se encuentra en todos los enfermos afectados de DCP, y en algunos casos se acompañan de pólipos nasales y disminución o pérdida completa del olfato. En la TAC de senos es típico observar ocupación de los senos etmoidales y maxilares, junto a hipoplasia del seno frontal. El diagnóstico se realiza mediante una combinación de pruebas, como son: tiempo de sacarina, óxido nítrico nasal, biopsia nasal, en la que se observa la frecuencia de batida de los cilios y la densidad de éstos mediante microscopia electrónica44. En el tratamiento del paciente con DCP resulta de gran importancia la fisioterapia respiratoria con drenaje postural y la antibioterapia en las agudizaciones por infecciones respiratorias. La realización de polipectomía endoscópica o de cirugía endoscópica funcional de senos es beneficiosa en los pacientes con rinosinusitis crónica rebelde al tratamiento.
El diagnóstico se establece por el estudio ultraestructural de muestras obtenidas de la mucosa nasal, en las que se suele observar la ausencia de los brazos de la dineína o la disposición anómala de los microtúbulos. Estudios recientes han demostrado concentraciones bajas de óxido nítrico nasal en los pacientes afectados de dicha enfermedad45.
Síndrome de Young
El síndrome de Young se caracteriza por la tríada: bronquiectasias, rinosinusitis crónica e infertilidad. En los pacientes que lo presentan la actividad ciliar es normal y el moco, muy viscoso. La biopsia nasal bajo microscopia electrónica no muestra cambios en la estructura de los cilios46. La azoospermia causante de la infertilidad se debe a la obstrucción del epidídimo, ya que la espermiogénesis es totalmente normal. El diagnóstico se basa en la clínica (enfermedad sinopulmonar crónica, azoospermia), así como en la exclusión de FQ y de síndromes de inmovilidad ciliar47.
Deficiencia de alfa-1-antitripsina
La alfa-1-antitripsina es una glucoproteína producida por los hepatocitos, cuya función es inhibir las proteasas (elastasa), en particular las liberadas por los neutrófilos, en su misión reparadora y de limpieza de agentes externos en el pulmón. Al inhabilitar las proteasas, evita la destrucción de tejidos sanos en el organismo48. El gen que la codifica está situado en el cromosoma 14. El déficit pulmonar de alfa-1-antitripsina produce enfisema por la destrucción progresiva de los alveolos en la tercera y cuarta décadas de la vida. El humo del tabaco contribuye a la destrucción pulmonar, ya que aumenta la actividad de la elastasa, disminuye la actividad de la alfa-1-antitripsina por su oxidación e inactiva la síntesis de elastina, lo que interfiere en la reparación pulmonar; por lo tanto, dejar de fumar debe ser la principal prioridad del paciente diagnosticado de déficit de alfa-1-antitripsina49.
El enfisema producido por el déficit de alfa-1-antitripsina es paracinar, con destrucción de todo el ácino. Se localiza frecuentemente en las bases y existe un aumento de la distensibilidad (compliance) pulmonar. La disminución de las concentraciones de alfa-1-antitripsina produce un desequilibrio entre esta proteína (antiproteasa) y la elastasa (proteasa). Al no existir suficiente cantidad de alfa-1-antitripsina, las elastasas siguen destruyendo progresivamente la elastina de las paredes alveolares50. Se consideran valores normales de proteína alfa-1-antitripsina en sangre los comprendidos en el intervalo de 150 a 350 mg/dl o 20-53 µM. Con concentraciones inferiores a 80 mg/dl u 11 µM existe el riesgo de padecer alguna de las enfermedades relacionadas con su déficit51. El segundo órgano más afectado es el hígado, afectando más frecuentemente a recién nacidos y niños. Los pacientes afectados presentan historia previa de déficit de alfa-1-antitripsina o de enfermedad pulmonar. En el pulmón se observan enfisema, bronquitis crónica, bronquiectasias, asma de difícil tratamiento y neumo-nías de repetición. Se recomienda realizar mediciones cuantitativas de alfa-1-antitripsina en los siguientes casos: enfisema precoz, antecedentes familiares, disnea o tos en varios miembros de una misma familia o diferentes generaciones, adultos con bronquiectasias sin etiología evidente, pacientes con enfermedad obstructiva pulmonar, enfermedad hepática de causa desconocida, pacientes asmáticos que no responden a tratamiento y en la paniculitis inexplicable52. La rinitis alérgica y las rinosinusitis de repetición también constituyen una manifestación frecuente en estos pacientes incluso en ausencia de enfermedad obstructiva pulmonar53.
Conclusiones
De acuerdo con el concepto de "una única vía, una sola enfermedad", los pacientes afectados de bronquiectasias presentan en muchos casos afectación nasosinusal. Se desconoce la frecuencia de esta asociación, ya que no se ha realizado un estudio sistemático de afectación nasosinusal en pacientes con bronquiectasias. No se sabe, por ejemplo, si los gérmenes que colonizan las vías inferiores son los responsables del proceso nasal. Tampoco se ha investigado si las características de la respuesta inflamatoria de las vías bajas son similares a las nasales y sinusales. Dada la mejor accesibilidad de la nariz en la realización de exploraciones (endoscopia, biopsia, recogida de secreciones nasales) en comparación con las vías inferiores (fibrobroncoscopia), el control evolutivo de la enfermedad pulmonar podría mejorar y ser menos invasivo. Se ha demostrado que el tratamiento de la rinitis alérgica y la poliposis nasal mejora la evolución del paciente con asma, pero se desconoce si algo similar puede ocurrir entre la sinusitis y las bronquiectasias. La demostración de la presencia de un proceso infeccioso e inflamatorio similar de las vías aéreas superiores e inferiores de los pacientes con bronquiectasias permitirá realizar estudios encaminados a aclarar los mecanismos responsables de su origen.
Correspondencia: Dr. J.M. Guilemany.
Servei d'ORL. Hospital Clínic.
Villarroel, 170, esc. 8, pl. 2. 08015. Barcelona. España.
Correo electrónico:33785jgt@comb.es
Recibido: 15-3-2005; aceptado para su publicación: 5-4-2005.