Subvencionado, en parte, por ABEMAR y Red Respira (RTIC C03/11, Fondo de Investigación Sanitaria, Instituto de Salud Carlos III).
Introducción
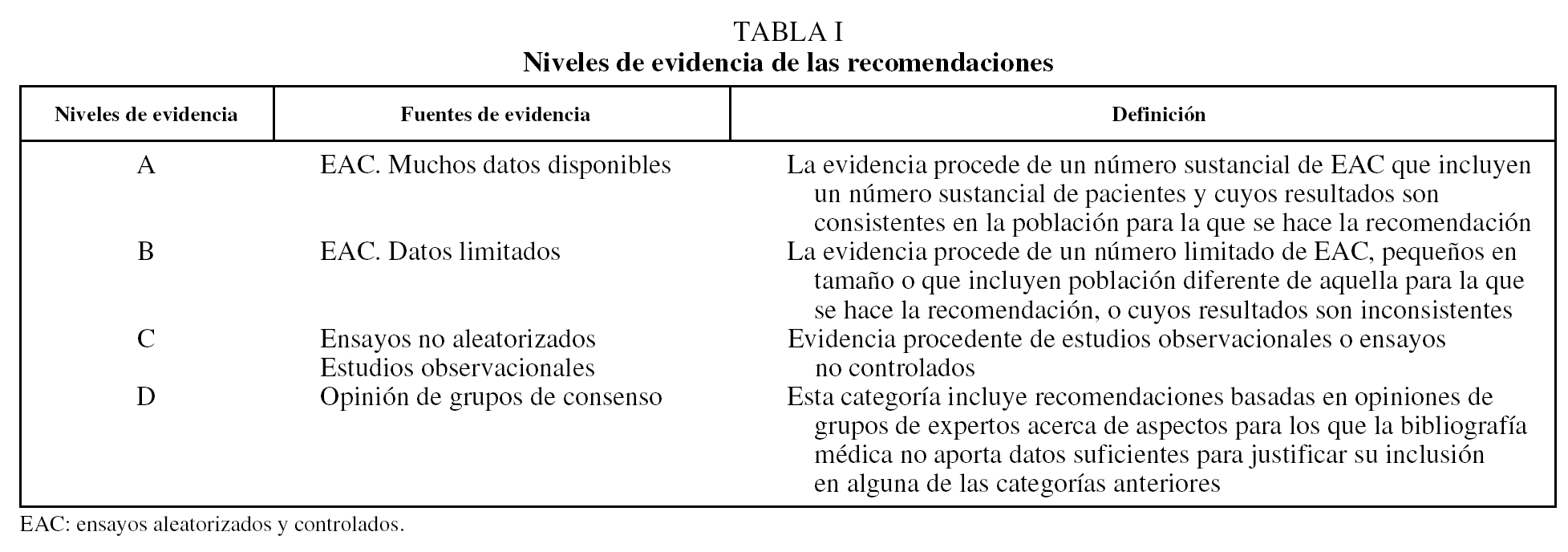
Este artículo presenta una visión integrada del tratamiento de los pacientes hospitalizados por agudización de enfermedad pulmonar obstructiva crónica (AEPOC)1-5, basada en la mejor evidencia médica disponible (tabla I).
El tratamiento hospitalario de la AEPOC persigue varios objetivos2,5: a) la estabilización respiratoria y hemodinámica del paciente; b) la mejoría o, si es posible, normalización del estado clínico basal del paciente; c) el diagnóstico de la(s) causa(s) de la AEPOC; d) la evaluación de la gravedad de la EPOC y la identificación de cualquier posible comorbilidad presente; e) la educación del paciente en el correcto uso de la medicación y los equipos terapéuticos (nebulizadores, inhaladores, oxigenoterapia, etc.), así como la promoción de un estilo de vida saludable antes del alta, y f) por último, la evaluación de la necesidad de tratamiento adicional en el domicilio, como rehabilitación respiratoria y/u oxigenoterapia domiciliaria. La consecución de estos objetivos requiere el manejo del paciente en diferentes niveles asistenciales del hospital: área de urgencias, sala de hospitalización, unidad de cuidados intensivos (UCI).
En esta revisión se abordarán: a) el manejo clínico inicial del paciente con AEPOC en el área de urgencias; b) los criterios de ingreso hospitalario; c) el tratamiento de la AEPOC en la sala de hospitalización convencional; d) el manejo de la AEPOC en la UCI, y e) los criterios de alta desde cada uno de estos niveles asistenciales. Tras ello, se identificarán los aspectos que a juicio de los autores no están resueltos y precisan más investigación.
Manejo clínico en la sala de urgencias
Valoración inicial
En la tabla II se presentan los componentes principales de la evaluación inicial de un paciente con sospecha de AEPOC en el área de urgencias. La información aportada por la historia clínica, el examen físico, la radiografía de tórax y la gasometría arterial permiten: a) establecer el diagnóstico de AEPOC; b) su gravedad, y c) decidir la necesidad de hospitalización, oxigenoterapia y/o soporte ventilatorio (nivel de evidencia D)6,7. Por el contrario, la gravedad de la obstrucción al flujo aéreo determinada en condiciones de estabilidad clínica (antes de la AEPOC) no es útil para evaluar la gravedad del actual episodio de AEPOC, la necesidad de hospitalización y/o el momento del alta6-8. Finalmente, es necesario descartar (o tratar, si es preciso) otros procesos concurrentes que pueden contribuir a empeorar el estado clínico del paciente. Los más importantes, por su frecuencia y/o gravedad, son la insuficiencia cardíaca, la embolia pulmonar, la neumonía y/o la toma de sedantes. Ninguno de ellos, sin embargo, debe considerarse conceptualmente causa de AEPOC9.
Medidas terapéuticas
Oxigenoterapia. Si la situación clínica lo permite, se recomienda obtener una gasometría arterial antes de iniciar la oxigenoterapia. A continuación se iniciará la oxigenoterapia con la fracción inspiratoria de oxígeno (FiO2) necesaria para alcanzar una presión arterial de oxígeno superior a 60 mmHg (8,0 kPa) o una saturación arterial de oxígeno (SaO2) superior al 90%, sin provocar acidosis por aumento de la presión arterial de anhídrido carbónico (PaCO2) (nivel de evidencia A)2-5,10.
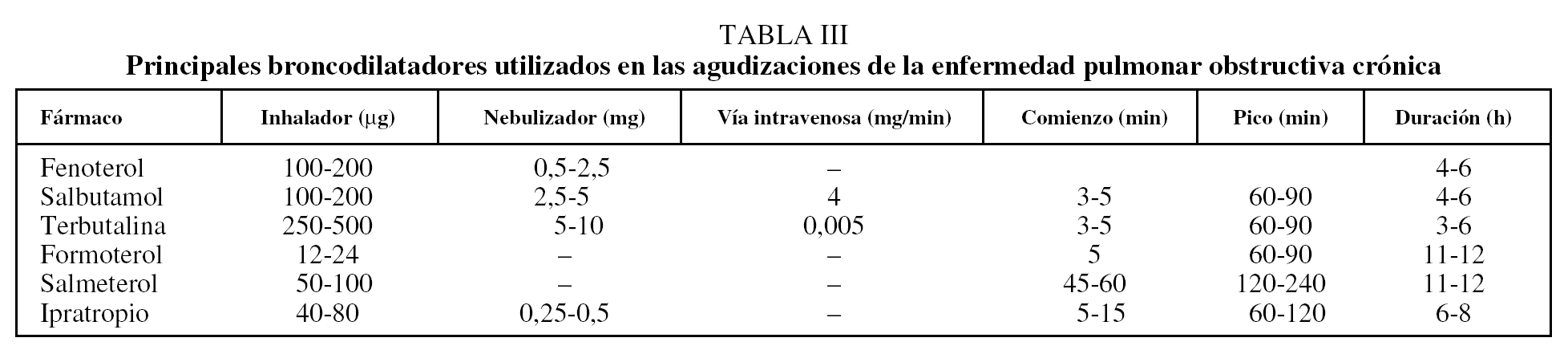
Broncodilatadores. Los agonistas β2 de corta duración en aerosol son los broncodilatadores de elección en el tratamiento inicial de AEPOC2,3,10 (tabla III) (nivel de evidencia A). Si no se obtiene una rápida respuesta con dosis altas de estos fármacos, se recomienda añadir anticolinérgicos (nivel de evidencia B)2,5,8,10. La administración de agonistas β2 por vía subcutánea o intravenosa sólo debe considerarse cuando la vía inhalatoria no está disponible y existe riesgo vital para el paciente.
Glucocorticoides. Administrados por vía oral o intravenosa, los glucocorticoides son eficaces en el tratamiento de la AEPOC (evidencia A)6,7,10. De forma empírica, se recomiendan dosis iniciales de 0,5 mg/kg/6-8 h de prednisolona (evidencia D)3,4,10.
Antibióticos. El uso de antibióticos en el tratamiento de las AEPOC es controvertido. Cuando se utilizan técnicas diagnósticas invasivas y sofisticadas (como cepillado protegido del árbol traqueobronquial por vía endoscópica), sólo se aíslan gérmenes potencialmente patógenos en alrededor del 65% de los episodios de AEPOC. Sólo en estos casos (y posiblemente no en el 35% restante) estaría indicado el empleo de antibióticos en la AEPOC. Sin embargo, estas técnicas diagnósticas invasivas no suelen utilizarse en la práctica clínica diaria. Por ello, siguiendo las recomendaciones de Anthonisen et al11, se aconseja el tratamiento con antibióticos en las AEPOC que cumplan al menos 2 de los siguientes criterios: a) aumento de la disnea habitual del enfermo; b) fiebre; c) aumento del volumen de esputo, y d) aumento del grado de purulencia del esputo. Estos criterios se han ampliado posteriormente a todos aquellos episodios de AEPOC que se acompañan de insuficiencia respiratoria aguda (o crónica agudizada) (evidencia B)3-5,7,10.
Otras medidas. El tratamiento en el área de urgencias debe considerar la indicación de diuréticos y anticoagulantes, la administración de fluidos y electrólitos, y el tratamiento de cualquier otra enfermedad asociada que lo precise.
Criterios de ingreso hospitalario
Todavía no existen marcadores biológicos útiles que permitan el diagnóstico específico de AEPOC o que sirvan como criterio objetivo de ingreso hospitalario. Por ello, la necesidad de ingresar al paciente se basa en la valoración de su situación clínica, en la respuesta al tratamiento inicial y en la presencia y gravedad de la comorbilidad asociada. En la tabla IV se muestran los criterios comúnmente recomendados para guiar la decisión de ingreso hospitalario en pacientes con AEPOC2-5,10. Aunque ninguno de ellos supone una indicación absoluta, la acumulación de varios de ellos refuerza la necesidad de tratamiento hospitalario (evidencia D).
Tratamiento del paciente en la sala de hospitalización
En este apartado cabe diferenciar el tratamiento farmacológico (broncodilatadores, glucocorticoides, antibióticos, etc.) de las medidas terapéuticas de tipo no farmacológico (oxigenoterapia, ventilación no invasiva, etc.).
Tratamiento farmacológico
Broncodilatadores. Los principales fármacos broncodilatadores disponibles para el tratamiento de la AEPOC son los agonistas β2 de corta duración y los anticolinérgicos (evidencia A)7,12. Aunque ambos fármacos son equipotentes6,7,13, se recomienda iniciar el tratamiento con agonistas β2 de corta duración por su mayor rapidez de inicio de acción (evidencia A)2,10. Cuando la respuesta clínica a dosis elevadas de agonistas β2 de corta duración no es satisfactoria, se aconseja añadir anticolinérgicos2-5,10, aunque no hay evidencia firme que indique que combinar ambos fármacos sea mejor que incrementar la dosis de cualquiera de ellos10,13.
Los agonistas β2 de corta duración y anticolinérgicos (tabla III) se suelen administrar cada 4-6 h, aunque esta periodicidad se puede acortar en caso necesario. La administración por vía inhalatoria es la más eficaz y la que menos efectos secundarios produce (evidencia A)6,7. En pacientes hospitalizados, los fármacos broncodilatadores se suelen administrar mediante nebulizador, aunque los dispositivos de inhalación son igualmente efectivos si la situación clínica del paciente le permite coordinar correctamente la maniobra inhalatoria (evidencia A)2,7.
En AEPOC graves que no se controlan satisfactoriamente con agonistas β2 de corta duración y anticolinérgicos pueden añadirse al tratamiento metilxantinas en infusión continua (bolo de aminofilina: 2,5-5 mg/kg administrado en 30 min, seguido de perfusión de mantenimiento de 0,5 mg/kg/h) (evidencia B)2,3,10,14-16. Su prescripción exige una estrecha monitorización de las concentraciones del fármaco en suero2-4,10,14. Todavía no existe evidencia suficiente para recomendar el uso de agonistas β2 de larga duración o de tiotropio en el tratamiento de la AEPOC.
Glucocorticoides. Los glucocorticoides sistémicos son eficaces en el tratamiento de la AEPOC (evidencia A)6,7,10,17. Aceleran la recuperación del volumen espiratorio forzado en el primer segundo, acortan el período de estancia hospitalaria y disminuyen el número de reingresos por AEPOC7,18-21. Sin embargo, no hay estudios concluyentes sobre la dosis y duración óptima del tratamiento con glucocorticoides en estas circunstancias. Habitualmente se recomienda una dosis de 0,5 mg/kg/6-8 h de prednisolona por vía oral o intravenosa durante las primeras 72 h, con disminución progresiva posterior3,4,10,22, hasta su retirada completa en 2 semanas (evidencia D)3,7,10,20. En AEPOC sin acidosis, los corticoides nebulizados podrían ser tan eficaces como los sistémicos con menos riesgo de efectos secundarios23. Sin embargo, todavía no hay evidencia suficiente para recomendar su uso en las AEPOC.
Antibióticos. Como se ha mencionado previamente, el uso de antibióticos es un aspecto controvertido del tratamiento de la AEPOC. Las infecciones del árbol traquebronquial (virales o bacterianas) son una causa importante de AEPOC, pero posiblemente no la única24. Así, mediante el empleo de técnicas invasivas es posible aislar gérmenes potencialmente patógenos en las secreciones respiratorias en aproximadamente el 65% de los pacientes con AEPOC25. Sin embargo, teniendo en cuenta que, en condiciones estables, alrededor del 35% de estos pacientes están crónicamente colonizados por bacterias8,25, cabe concluir que sólo se identifican nuevas bacterias en el 30% de los episodios de AEPOC. Los virus también pueden desempeñar un papel etiológico relevante y, de hecho, usando la reacción en cadena de la polimerasa para detectar la presencia de genoma viral, se puede identificar la presencia de virus en alrededor del 30% de los episodios de AEPOC26. Sin embargo, la coexistencia de virus y bacterias es frecuente. En suma, la infección bacteriana probablemente desempeña un papel patogénico importante en algunos (pero no todos) los episodios de AEPOC. En teoría, por tanto, los antibióticos debieran estar indicados únicamente en estos casos. El problema, obviamente, es cómo identificar los episodios de AEPOC que son debidos a infección bacteriana y, por tanto, tributarios de tratamiento antibiótico. Ésta es un área que necesita investigarse exhaustivamente. Por el momento, se recomienda tratamiento antibiótico en los episodios de AEPOC que cumplen al menos 2 de los siguientes criterios: a) aumento de la disnea habitual; b) fiebre; c) aumento del volumen de esputo, y d) aumento de la purulencia del esputo (evidencia B)3,4,7,10,11. Los antibióticos también están indicados en las AEPOC que cursan con insuficiencia respiratoria aguda o crónica agudizada (evidencia B)3,6,7,27. Las bacterias más comúnmente aisladas en la AEPOC son Streptococcus pneumoniae, Haemophilus influenzae y Moraxella catarrhalis25. En pacientes con EPOC grave (volumen espiratorio forzado en el primer segundo inferior al 35% del valor de referencia) las infecciones por bacilos gramnegativos, especialmente enterobacterias y Pseudomona, son frecuentes28. Basándose en estos datos epidemiológicos y espirométricos, en los pacientes en quienes se considere indicado el tratamiento antibiótico, se recomienda el empleo de cefalosporinas, penicilinas de amplio espectro o quinolonas antipseudomónicas2,8,12,28,29. En todo caso, la elección del antibiótico debe basarse en la sensibilidad local de los citados gérmenes y en los antibióticos administrados al paciente antes del ingreso.
Otras medidas farmacológicas:
- Heparina de bajo peso molecular. Se recomienda su administración subcutánea en pacientes inmovilizados, policitémicos, deshidratados o con historia de enfermedad tromboembólica previa.
- Diuréticos. Indicados cuando hay signos clínicos de insuficiencia cardíaca derecha, como edema maleolar o ingurgitación yugular.
- Balance líquido y electrolítico. Las carencias de magnesio, calcio, fosfato y potasio son relativamente frecuentes en pacientes con EPOC y pueden empeorar durante la AEPOC2,30,31. La monitorización del balance hidroelectrolítico durante el ingreso (y su corrección en caso necesario) es importante en el manejo clínico de la AEPOC2,10.
- Soporte nutricional. Con frecuencia los pacientes con EPOC presentan desnutrición y pérdida de peso32. Esta situación puede empeorar significativamente durante las AEPOC que precisan hospitalización32. A pesar de ello, la nutrición enteral sólo se recomienda en pacientes con disnea grave que dificulta la nutrición oral10.
- Estimulantes respiratorios. No hay evidencia de que fármacos como doxapram, almitrina, protriptilina, medroxiprogresterona o acetazolamida sean útiles en la AEPOC33-35 y, en general, se desaconseja su utilización2-5.
Medidas terapéuticas no farmacológicas
Oxigenoterapia. La insuficiencia respiratoria está casi invariablemente presente en pacientes hospitalizados por AEPOC. Por ello, el tratamiento con oxígeno es una de las piedras angulares del tratamiento hospitalario de la AEPOC. El objetivo de la oxigenoterapia es alcanzar una presión arterial de oxígeno superior a 60 mmHg (8,0 kPa) o una SaO2 superior al 90%, sin provocar retención de anhídrido carbónico o acidosis (evidencia A)2-5,10. Para ello suele ser suficiente el empleo de una FiO2 del 24-28%3,4,12. Estas concentraciones de oxígeno se pueden administrar mediante gafas nasales (más cómodas) o mascarillas tipo Venturi, que permiten controlar mejor la precisión de la FiO2 administrada3,10,36. Si se necesita administrar FiO2 superiores al 40%, se recomienda utilizar mascarillas no reinhaladoras con válvula unidireccional2.
Dado que la FiO2 a emplear se elige de forma empírica y que sus efectos sobre la oxigenación arterial, retención de anhídrido carbónico y pH no pueden preverse con precisión, es recomendable obtener una gasometría arterial 30 min después del inicio de la oxigenoterapia. Esto permite una correcta evaluación de los efectos de la FiO2 administrada y su ajuste (al alza o a la baja) si es necesario. Por las mismas razones, debe obtenerse otra gasometría arterial siempre que se modifique la FiO2 (o cuando la situación clínica del paciente cambie significativamente)35. La monitorización de la SaO2 con el oxímetro sólo es aceptable una vez que la gasometría arterial ha demostrado que el pH y la PaCO2 son normales3.
Fisioterapia respiratoria. No existe evidencia firme de la utilidad de la fisioterapia en pacientes hospitalizados por AEPOC. Incluso puede llegar a ser perjudicial3,6,7,37. Sólo en pacientes seleccionados, con broncorrea mayor de 25 ml/día, se pueden considerar técnicas como la tos dirigida (huff coughing), el drenaje postural con/sin vibración o la percusión (evidencia D)2,10. Los mucolíticos, los expectorantes y la sobrehidratación cuando el paciente no está deshidratado no han demostrado ser de utilidad en pacientes con AEPOC6,7.
Ventilación mecánica no invasiva. El empleo de la ventilación mecánica no invasiva (VMNI) fuera del ámbito de una UCI es un aspecto controvertido del tratamiento de la AEPOC38. Sus ventajas e inconvenientes, así como los criterios de inclusión y exclusión, se discuten en el siguiente apartado.
Tratamiento en la unidad de cuidados intensivos
Medidas generales y tratamiento farmacológico
Las medidas de cuidado general y las diversas opciones farmacológicas discutidas anteriormente para el tratamiento de las AEPOC en la sala de hospitalización (broncodilatadores, esteroides, antibióticos, oxigenoterapia, etc.) son aplicables a los pacientes que precisan cuidados intensivos (tabla V), por lo que no volveremos a comentarlos. A continuación se evalúan las opciones terapéuticas más específicas de las UCI.
Ventilación mecánica
Los pacientes con AEPOC pueden necesitar soporte ventilatorio. Éste se puede administrar de forma invasiva (es decir, a través de un tubo endotraqueal conectado a un ventilador) o no invasiva (por medio de una mascarilla nasal o facial que evite la necesidad del tubo endotraqueal). En ambos casos, sin embargo, los objetivos terapéuticos son los mismos: por un lado, disminuir la morbimortalidad de la AEPOC, y por otro, mejorar los síntomas del paciente.
Ventilación mecánica no invasiva. La VMNI es un tratamiento eficaz y de primera línea (añadido al tratamiento convencional) para los pacientes con AEPOC y fracaso respiratorio39-42 (evidencia A). En estos pacientes, la VMNI permite: a) disminuir el valor de PaCO2 y aumentar el del pH arterial; b) mejorar los síntomas derivados de la fatiga de los músculos respiratorios (como la disnea); c) reducir la estancia hospitalaria media de los pacientes (evidencia A), y d) disminuir la necesidad de intubaciones, el número de complicaciones y la mortalidad hospitalaria40,42-45. En la tabla VI se presentan los criterios de selección y exclusión para VMNI.
Una reciente conferencia de consenso concluye que la VMNI debe administrarse sólo en las UCI o en otras unidades que garanticen un alto nivel de monitorización (evidencia D)39. Existe información contradictoria sobre la administración de VMNI en salas de hospitalización46,47. Actualmente se acepta que la VMNI fuera del ámbito de UCI está indicada en los pacientes con AEPOC que no han respondido al tratamiento inicial y que: a) presenten valores de PaCO2 que condicionen cifras de pH de 7,30 o mayores (evidencia D)39, o b) por razones clínicas (edad o comorbilidad) u operativas (falta de camas) no vayan a ser admitidos en la UCI. La VMNI podrá iniciarse en el área de urgencias sólo si se dispone de personal entrenado en esta técnica y de equipo adecuado para monitorizar al paciente39.
El uso correcto de la VMNI requiere (evidencia D): a) monitorizar estrechamente la saturación de la oxihemoglobina (SaO2), gasometría arterial y signos vitales; b) adaptación correcta del paciente a la VMNI a fin de evitar las fugas aéreas y conservar su capacidad para expectorar, y c) disponer de los recursos humanos (y técnicos) con suficiente experiencia para afrontar las posibles complicaciones.
En el tratamiento de pacientes con AEPOC se pueden emplear 4 modalidades diferentes de VMNI: a) ventilación asistida-controlada ciclada por volumen43; b) ventilación mediante presión de soporte44; c) ventilación ciclada por presión45, y d) ventilación con 2 niveles de presión, una inspiratoria y otra espiratoria46,48. La elección del modo de ventilación se realiza en función de la experiencia del equipo responsable.
La VMNI debe ajustarse individualmente para alcanzar los siguientes objetivos: a) mejorar los síntomas; b) mejorar el intercambio de gases, y c) evitar efectos indeseables39. La VMNI precisa una mascarilla para aplicar la ventilación al paciente. Existen 2 tipos de mascarilla: las faciales, que cubren la nariz y la boca, y las nasales, que cubren sólo la nariz. No hay evidencia suficiente que demuestre que una mascarilla es mejor (o peor) que la otra. Sin embargo, la facial permite aplicar presiones mayores con menores fugas, requiere menos colaboración del paciente y permite respirar por la boca. Por el contrario, son menos cómodas que las nasales y dificultan otras funciones fisiológicas, como comer o hablar. Por otra parte, la mascarilla nasal precisa un alto grado de colaboración del paciente, que debe mantener los labios cerrados para evitar las fugas. La elección de un tipo de mascarilla particular para un paciente determinado depende de la disponibilidad, experiencia del equipo médico e, importante, el grado de adaptación de cada paciente a un determinado tipo de mascarilla. Aunque posiblemente lo ideal sea administrar la VMNI durante 24 h al día, en la práctica se administra 6-12 h al día, en función de la tolerancia individual de cada paciente.
Ventilación mecánica invasiva
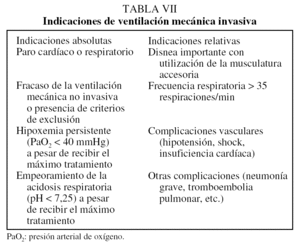
A pesar de los beneficios de la VMNI respecto a la ventilación mecánica invasiva (VMI)44, existen indicaciones concretas para utilizar esta última (tabla VII). En pacientes con AEPOC los objetivos de la VMI son: a) corregir el intercambio pulmonar de gases respiratorios y la acidosis respiratoria49; b) administrar soporte vital mientras los pacientes reciben tratamiento para corregir la causa de la agudización, y c) descansar y recuperar los músculos respiratorios de la fatiga50. Las complicaciones derivadas de la VMI incluyen: barotrauma51, lesión ultraestructural con cambios en la permeabilidad del tejido pulmonar52 y neumonía asociada al ventilador. La mortalidad entre los pacientes con AEPOC y fracaso respiratorio que requieren VMI no es superior a la de pacientes ventilados por otras causas10. Algunos aspectos específicos de la VMI en el contexto de la AEPOC deben considerarse individualmente:
- Intubación traqueal. En las situaciones clínicas agudas como la AEPOC, la intubación traqueal por vía oral es de elección53. Si se utiliza la vía nasal aumenta el riesgo de sinusitis54, se incrementa la resistencia de la vía aérea55 y se reduce la liberación bronquial de la medicación en aerosol56. El fibrobroncoscopio puede ser útil para guiar la intubación traqueal en situaciones difíciles (como en pacientes con anormalidades de la anatomía facial).
- Modalidades de ventilación. En pacientes con AEPOC se pueden emplear 2 estrategias ventilatorias diferentes: a) la VMI asistida-controlada, ciclada por volumen o por presión, y b) VMI mediante presión de soporte. No existen estudios que comparen las diferentes formas de ventilación en la AEPOC.
En pacientes con AEPOC la VMI disminuye el nivel de presión positiva intrínseca al final de la espiración (PEEPi) y el grado de hiperinsuflación dinámica (HID). Para conseguirlo, la VMI asistida-controlada en estos pacientes combina valores bajos de volumen corriente (entre 8 y 10 ml·kg1) y una relación tiempo espiratorio/tiempo inspiratorio larga. Para ello se precisa emplear frecuencias respiratorias bajas y flujos inspiratorios altos57. Además, la utilización de presión positiva externa al final de la espiración (PEEPe) permite equilibrar el valor de PEEPi58 y, con ello, reducir tanto el trabajo respiratorio como el grado de atrapamiento aéreo (y, por tanto, la PEEPi)59,60. Se administran valores de PEEPe inferiores a los de PEEPi para evitar acentuar la hiperinsuflación dinámica59,60. Otra estrategia ventilatoria que puede usarse en pacientes con AEPOC es la llamada hipoventilación controlada con hipercapnia permisiva, que se ha utilizado ampliamente en el distrés respiratorio agudo para minimizar las complicaciones derivadas de la VMI61. En pacientes con AEPOC y obstrucción grave al flujo aéreo, la hipoventilación controlada con hipercapnia permisiva permite disminuir sus elevados niveles de HID y PEEPi (evidencia D)53. En cualquier caso, cualquiera que sea la modalidad de VMI asistida-controlada que se emplee, es imprescindible monitorizar tanto las cifras de PEEPi como las presiones pico y meseta. La primera informa de cambios en la mecánica respiratoria y en la resistencia en la vía aérea, y las últimas reflejan el grado de insuflación y distensibilidad pulmonar49.
La ventilación con presión de soporte es más cómoda que la VMI asistida-controlada debido a que el paciente (no el ventilador) controla el volumen corriente. También permite reducir la HID y la PEEPi. El ajuste de la presión de soporte ventilatorio se realiza en función del volumen corriente y de la frecuencia respiratoria (que debe ser inferior a 30 respiraciones/min)62. Se utiliza en pacientes con AEPOC que puedan mantener valores adecuados de volumen corriente y frecuencia respiratoria. En los pacientes que requieran reposo absoluto de la musculatura respiratoria y en los que presentan problemas de adaptación a la presión de soporte ventilatorio debe emplearse VMI asistida-controlada.
- Sedación, analgesia y parálisis. En pacientes con AEPOC sometidos a VMI se necesita cierto grado de sedación y analgesia para facilitar su adaptación al ventilador, disminuir la HID y reducir el consumo de oxígeno y la producción de anhídrido carbónico53. Si no existen contraindicaciones específicas se recomienda el empleo de propofol, ya que este fármaco tiene cierto efecto broncodilatador63 y evita la utilización de fármacos miorrelajantes64. Las benzodiazepinas y los opiá-ceos, solos o asociados, son fármacos alternativos. El haloperidol es el más adecuado en las maniobras de destete debido a que no deprime el centro respiratorio. La administración intermitente (a demanda) de estos fármacos es la más adecuada, ya que la sedación continua prolonga el tiempo de VMI y los costes del tratamiento65,66. Los fármacos miorrelajantes sólo se administran en casos de HID extrema y de ventilación no efectiva por falta de adaptación al ventilador.
- Administración de tratamiento broncodilatador durante la VMI. El tratamiento broncodilatador administrado mediante inhalador o nebulizador se ha demostrad69 y se considera de elección a pesar de que es menos efectivo durante la VMI. La administración del fármaco con inhalador o nebulizador proporciona beneficios equivalentes70. La utilización de broncodilatadores y corticoides por vía sistémica tiene las mismas indicaciones y produce los mismos efectos favorables o secundarios que cuando se administran fuera de una UCI.
- Destete (weaning) de la VMI. Los pacientes pueden ser extubados cuando se ha corregido (o mejorado significativamente) la causa de la AEPOC y se encuentran clínicamente estables. Las extubaciones prematuras provocan: a) aumento de la mortalidad (por parada cardíaca, neumonía y/o aspiración)71; b) prolongación del tiempo de estancia en las UCI, y c) necesidad de rehabilitación física durante largos períodos72. La utilización de tubos en T73 o VMNI74 facilita el proceso de destete. Para el destete de pacientes con AEPOC, la utilización de técnicas no invasivas de ventilación ofrece ventajas respecto a la presión de soporte invasiva: a) reduce el tiempo de destete; b) acorta la estancia en la UCI; c) disminuye el riesgo de neumonía nosocomial, y d) mejora la supervivencia en los primeros 60 días después del alta de la UCI (evidencia B)74.
Criterios de alta hospitalaria
Desde la unidad de cuidados intensivos
No existen criterios definidos para dar de alta a un paciente ingresado en la UCI. Sin embargo, la experiencia clínica aconseja considerarla en los pacientes que cumplen los siguientes criterios: a) corrección (o mejora significativa) de la causa de la agudización; b) ausencia de complicaciones médicas relevantes que puedan interferir en la estabilidad del paciente; c) no necesidad de soporte ventilatorio, y d) no precisar monitorización exhaustiva.
Desde la sala de hospitalización convencional
No se conoce el tiempo de estancia hospitalaria ideal de un paciente con AEPOC. Esto se debe, fundamentalmente, a la falta de criterios objetivos para determinar el momento del alta hospitalaria. Los disponibles se basan únicamente en la opinión de grupos de expertos2,10. En la tabla VIII se exponen los criterios recientemente propuestos por la iniciativa GOLD (Global Initiative for Chronic Obstr0.
Programas de alta temprana y soporte domiciliario
Los criterios de alta hospitalaria descritos en la tabla VIII probablemente cambiarán en el futuro con la reciente aparición de los programas de alta hospitalaria temprana y soporte domiciliario. Cada vez hay más estudios publicados que avalan la disponibilidad, seguridad, aceptación y coste-eficacia de estos programas alternativos75-80. Estos estudios han demostrado que alrededor del 20-30% de los pacientes con AEPOC que acuden a urgencias, y que de otra manera serían hospitalizados, pueden ser derivados directamente a su domicilio y tratados de forma segura y eficiente si se dispone de un apoyo de enfermería adecuado75,76,81. Además, estos estudios han subrayado la posibilidad de combinar estancias hospitalarias cortas con altas tempranas y soporte domiciliario en estos pacientes77,78. Esta última alternativa puede ofrecerse a un amplio grupo de pacientes con buenos resultados77,78.
Seguimiento ambulatorio
Se recomienda que los pacientes dados de alta del hospital por AEPOC tengan visitas ambulatorias 4-6 semanas después (evidencia D)10. Las variables a valorar en esta visita se muestran en la tabla IX. El seguimiento posterior se realiza como en cualquier paciente con EPOC estable3,10. La presencia de insuficiencia respiratoria durante la agudización obliga a evaluar ambulatoriamente el intercambio pulmonar de gases para decidir la indicación de oxigenoterapia domiciliaria. Esta decisión no debe tomarse sobre la base de los gases arteriales en el momento del alta10, sino cuando el paciente se encuentra en situación de estabilidad clínica (2-3 meses postalta).
Conclusiones y futuras áreas de investigación
A pesar de que muchos aspectos del tratamiento de la EPOC han cambiado significativamente en los últimos años82, lo que ha conducido a una mejora de la calidad y la esperanza de vida de estos pacientes, los episodios de hospitalización continúan siendo un gran problema para los servicios de salud de todo el mundo. En este artículo se han revisado los principios básicos de su tratamiento hospitalario intentando incorporar el nivel de evidencia para cada caso cuando esto era posible. Con ello, se contribuye a subrayar muchas de las lagunas de conocimiento sobre las que se carece del nivel de evidencia necesario y que, por tanto, precisan investigación. Lo que sigue es sólo un ejemplo de los puntos que, en opinión de los autores, son más urgentes o relevantes.
Mecanismos fisiopatológicos de la agudización de la EPOC
La fisiopatología de muchos episodios de AEPOC continúa siendo desconocida y, hasta que se consiga una mejor comprensión de los mecanismos que subyacen en estos episodios, su tratamiento continuará siendo fundamentalmente sintomático83. Tradicionalmente ha prevalecido la hipótesis de que la AEPOC significa, básicamente, "infección de la vía aérea". Sin embargo, incluso con la ayuda de técnicas invasivas y sofisticadas, no se identifican patógenos en un porcentaje sustancial de las AEPOC (alrededor de un 50% de ellas)25. Este hecho a menudo se pasa por alto pero, en opinión de los autores, indica la necesidad de mantener una actitud abierta en esta área. Por ejemplo, la "hipótesis infecciosa" está basada en la idea de un desencadenante "externo" de la AEPOC (en este caso, un virus o una bacteria). En teoría, sin embargo, también es posible que la AEPOC (al menos un cierto porcentaje de ellas) sean debidas a un factor "interno". De hecho, muchas enfermedades inflamatorias crónicas no infecciosas (p. ej., artritis reumatoide o colitis ulcerosa) también presentan episodios de agudización que, a diferencia de la EPOC, normalmente se consideran parte integral de la enfermedad. No sabemos si esto puede ocurrir en la EPOC (también una enfermedad inflamatoria), pero una mejor comprensión de la fisiopatología de los episodios de AEPOC puede facilitar el desarrollo de alternativas terapéuticas nuevas y más eficaces.
Mejor definición del papel de los tratamientos existentes
Muchas de las opciones terapéuticas actualmente disponibles para el tratamiento de las AEPOC han sido "heredadas" de otras enfermedades res piratorias (asma, neumonía) y, en muchos casos, todavía carecen de evidencia científica suficiente que determine su posición adecuada en la estrategia terapéutica intrahospitalaria. Por ejemplo, no se ha analizado el papel de los agonistas β2 de larga duración en el tratamiento de las AEPOC. Recientemente se ha comercializado un nuevo fármaco anticolinérgico, el tiotropio, con mayor vida media que el bromuro de ipratropio y mayor especificidad de acción sobre los diferentes subtipos de receptores muscarínicos84, lo que incrementa su potencia broncodilatadora. Sin embargo, actualmente no hay datos acerca de cuál puede ser su papel futuro en la AEPOC. Por otro lado, a pesar de que la ventilación no invasiva es claramente eficaz cuando se aplica en la UCI39, todavía no se sabe cuándo ni cómo utilizarla fuera de ella38,40,46,47,85. Por último, el empleo de antibióticos para el tratamiento de la AEPOC es un aspecto que sigue sin resolverse. Probablemente continuará siendo así hasta que seamos capaces de describir un marcador de "infección bacteriana de la vía aérea" que permita identificar a los pacientes que se beneficiarán del tratamiento antibiótico.
Criterios de ingreso y alta hospitalaria basados en la evidencia
Los criterios de ingreso y alta discutidos en este artículo se basan en la experiencia clínica y en la "opinión de expertos"2-5. En los últimos años se han publicado nuevas formas de manejo hospitalario de la AEPOC, entre ellas la hospitalización domiciliaria y el alta hospitalaria temprana con soporte domiciliario75-78,81. Estas nuevas formas de tratamiento precisan definiciones más precisas de los criterios de hospitalización y alta --basadas en evidencia médica si es posible e, idealmente, en la presencia de algún tipo de marcador biológico (la "troponina" de los cardiólogos)--. Esto puede permitir ofrecer a los pacientes un tratamiento mejor y más cómodo, así como un uso más racional de los recursos sanitarios.
Unidades de cuidados intermedios respiratorios
La VMNI ha demostrado su eficacia como tratamiento de soporte en la AEPOC39,86. Esta evidencia ha impulsado en los últimos años el desarrollo de unidades con un nivel de vigilancia intermedio entre la planta de hospitalización convencional y la UCI. Son unidades pensadas para prestar atención de alta calidad a enfermos con fallo de un solo órgano (en este caso, el aparato respiratorio) e insuficiencia respiratoria87. Ofrecen la posibilidad de aplicar VMNI y monitorización continua (oximetría, electrocardiograma, constantes vitales) a pacientes que no son tributarios de UCI o como puente hacia la planta de hospitalización convencional durante el destete de la VMI87. Comparadas con la UCI convencional, estas unidades necesitan menos personal de enfermería, permiten descargar la presión asistencial en las UCI, consumen menos recursos y tienen menos complicaciones87-89. Sin embargo, aún se necesitan estudios prospectivos que definan los criterios de ingreso en estas unidades89, así como estudios sobre su relación coste-beneficio y coste-efectividad87 en el tratamiento de la AEPOC.