Estas recomendaciones se circunscriben a las NAC que ocurren en personas adultas (de 18 o más años de edad) e inmunocompetentes. Quedan excluidas, por tanto, las NAC que afectan a niños o a pacientes con cáncer u otros estados de inmunodepresión, así como las que afectan a pacientes dados de alta hospitalaria en los 10 días previos, y también las neumonías de pacientes institucionalizados que pensamos que, como ocurre en las infecciones no neumónicas del tracto respiratorio inferior, requieren una consideración diferenciada que las coloca fuera del marco de estas recomendaciones.
Para la elaboración de estas recomendaciones, los autores de estas normativas han diferenciado 4 secciones: epidemiología, diagnóstico, escalas pronósticas y tratamiento. En cada una de ellas se ha efectuado una revisión bibliográfica y se ha confeccionado un documento inicial, discutido posteriormente en sesiones de debate interno por todos los miembros del panel, hasta conseguir elaborar un documento final conjunto. Las recomendaciones de este consenso se han graduado en 3 niveles de evidencia: nivel I (trabajos prospectivos, aleatorizados, bien diseñados y con metodología correcta), nivel II (trabajos prospectivos, controlados, bien diseñados, pero sin aleatorizar), y nivel III (casos retrospectivos y opinión de expertos). La redacción final del documento de consenso ha sido precedida de una revisión crítica por asesores que no habían participado en las reuniones previas.
Para facilitar la comprensión y la lectura rápida de estas recomendaciones se han elaborado abundantes tablas y un resumen, localizado al final del texto, donde se resaltan los puntos más destacados que, a nuestro entender, compendian el manejo diagnóstico, terapéutico y preventivo de las NAC.
Epidemiología
La NAC es una enfermedad frecuente, aunque de incidencia difícil de precisar, que en países europeos varía entre 5-11 casos/1.000 habitantes/año1,2. Dos series españolas de base poblacional realizadas en mayores de 14 años proporcionan cifras de 1,6-1,8 episodios/1.000 habitantes/año, con predominio en la época invernal y en ancianos del sexo masculino3,4 (nivel II de evidencia).
El porcentaje de pacientes con NAC que ingresan es muy variable: oscila entre el 22 y el 61%3,5. Las razones de esta variabilidad son diversas: criterios de ingreso heterogéneos, la posibilidad de atención en el servicio de urgencias hospitalario, la proporción de sujetos procedentes de asilos, o la disponibilidad de camas hospitalarias, entre otras. En nuestro país se ha comunicado que el 9% de los enfermos ingresados por NAC precisó atención en la unidad de cuidados intensivos (UCI)3.
En relación con las tasas de mortalidad, un metaanálisis realizado en un total de 33.148 pacientes incluidos en 127 estudios reflejó una mortalidad global del 14% que, sin embargo, alcanzaba el 37% en los pacientes atendidos en la UCI, y no superaba el 2% en los episodios de NAC tratados de forma ambulatoria6.
Etiología
El diagnóstico etiológico de la NAC no supera, en general, el 40-60% de los casos, dependiendo del número de técnicas empleadas. En la neumonía leve, en general tratada fuera del hospital, pocas veces está indicado establecer su causa. La etiología de la NAC según el lugar de atención del paciente es la siguiente:
NAC ambulatoria (grupo 1)
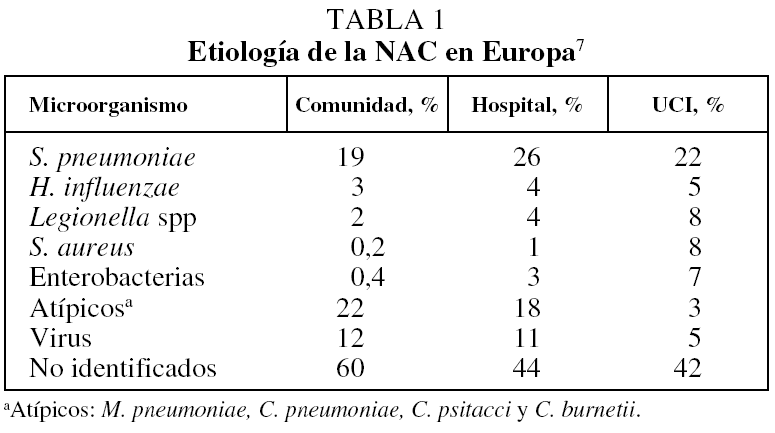
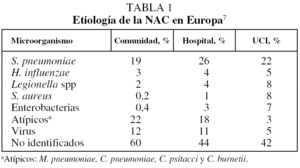
En la tabla I se muestran los hallazgos etiológicos más frecuentes en pacientes ambulatorios y hospitalizados en distintos países europeos7. Se analizan 41 publicaciones (12 de ellas españolas), de las que 9 tratan específicamente la NAC ambulatoria (nivel II). Algunos estudios españoles, realizados fundamentalmente con métodos de diagnóstico serológico, encuentran, como era de esperar, predominio de microorganismos atípicos8,9.
En una publicación reciente se relaciona la etiología de las neumonías con la escala pronóstica de Fine (nivel II), encontrando que, en el grupo I de esa escala, el 69% de los microorganismos eran «atípicos», especialmente Mycoplasma pneumoniae. Por el contrario, en los grupos II y III el 55% eran microorganismos «típicos», sobre todo Streptococcus pneumoniae10.
Por consiguiente, y basados en los datos actuales, el grupo de NAC tratado de forma ambulatoria está ocasionado, fundamentalmente, por S. pneumoniae y M. pneumoniae.
NAC hospitalizada (grupo 2)
El diagnóstico etiológico de los pacientes hospitalizados por NAC oscila entre un 40 y un 60%7,11-15 (nivel II); S. pneumoniae es el patógeno predominante. Al utilizar nuevos métodos de investigación etiológica se ha demostrado que al menos un tercio de las NAC no diagnosticadas por métodos convencionales eran neumocócicas16-18. La relevancia de los denominados patógenos «atípicos» (excluido Legionella spp.) depende de la intensidad de su búsqueda. En las series citadas estos microorganismos aparecen como causantes en el 20-35% de los casos, fundamentalmente M. pneumoniae. El 5-10% de las NAC están producidas por Haemophilus influenzae y bacilos gramnegativos (BGN), y es menos frecuente Staphylococcus aureus. La neumonía por aspiración constituye el 5% de las NAC15. Legionella spp. se puede presentar de manera esporádica durante todo el año, y de forma epidémica con mayor frecuencia en verano.
Su incidencia es mayor en el área mediterránea, aunque también ha habido brotes importantes en otras zonas de España, como Alcalá de Henares. En un estudio recientemente publicado en nuestro país los virus aparecen implicados en el 18% de las NAC, y son los únicos causantes en la mitad de estos casos19 (nivel II). En cualquier tipo de neumonía es posible aislar varios patógenos. Las asociaciones más frecuentes son las de microorganismos «típicos» y «atípicos», cuyo significado no está completamente aclarado. Debe considerarse la etiología mixta cuando se demuestre la existencia polimicrobiana de forma sincrónica y con métodos de certeza. En líneas generales, los resultados expuestos en trabajos españoles son superponibles a los europeos expresados en la tabla I.
NAC que ingresa en UCI (grupo 3)
En la mayoría de estudios europeos publicados en la pasada década, sobre todo en España (tabla I), S. pneumoniae y Legionella spp. causan el 50% de los casos de NAC grave20-24 (nivel II). Los BGN son la tercera causa en todas las series y, en nuestro país, también se debe considerar la posibilidad de una tuberculosis, particularmente en presencia de hemoptisis o en ausencia de aislamiento de otros microorganismos22. Por último, hay que valorar la posibilidad de patógenos oportunistas como Pneumocystis jiroveci asociado a la infección por el virus de la inmunodeficiencia humana (VIH) o Aspergillus spp. en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) con tratamiento esteroideo.
La mayor gravedad de los enfermos delimita el tipo de patógenos esperados y la rentabilidad de los métodos diagnósticos empleados. En los pacientes intubados el porcentaje de microorganismos desconocidos es significativamente menor que en los no intubados (el 33 frente al 53%); además, en aquéllos, la incidencia tanto de Pseudomonas aeruginosa (el 15 frente al 7%) como de Legionella pneumophila (el 6,6 frente al 1%) es significativamente superior25 (nivel III).
Etiología según los factores del huésped
Ancianos
En un trabajo prospectivo multicéntrico español sobre NAC en mayores de 65 años, se estableció la etiología en el 40% de los pacientes (nivel II); los microorganismos más frecuentemente implicados fueron: S. pneumoniae (49%), H. influenzae (14%) y L. pneumophila (8%)26. En otro estudio realizado sobre 1.475 adultos con NAC, se aisló S. pneumoniae en el 23% de los 305 pacientes mayores de 80 años, mientras que L. pneumophila fue causante de la NAC en sólo el 1% de este subgrupo de pacientes de mayor edad, cifra significativamente inferior al 8% alcanzado en enfermos de edad menor27 (nivel II). Aunque en España no hay series que hayan analizado la etiología de la neumonía adquirida en residencias de ancianos y en asilos, en Estados Unidos se han encontrado en estas situaciones diferentes agentes causantes a los aislados en episodios de neumonía contraídos en su domicilio destacando, en el primer caso, la elevada frecuencia de S. aureus (29%)28 (nivel II). No obstante, el único estudio realizado en el Reino Unido con un grupo control no confirma esos hallazgos29(nivel II).
Enfermedad pulmonar obstructiva crónica
Un estudio multicéntrico español realizado en pacientes con EPOC hospitalizados por NAC demostró que S. pneumoniae, Chlamydophila pneumoniae y H. influenzae fueron los principales agentes aislados30 (nivel II). En EPOC graves, sobre todo si existen bronquiectasias asociadas, otro patógeno que debe considerarse es P. aeruginosa31 (nivel II).
Otras enfermedades predisponentes
La insuficiencia cardíaca congestiva es un factor de riesgo para NAC e infecciones virales19. La diabetes mellitus favorece la neumonía neumocócica bacteriémica32 y la NAC por S. aureus33 (nivel II).
Consumo de alcohol
El alcoholismo es un factor independiente de riesgo de NAC, así como de la gravedad de su presentación34. Es difícil asociar una determinada etiología de la NAC a este hábito, dado que frecuentemente existen otras morbilidades asociadas. La neumonía por aspiración es un hecho frecuente en estos pacientes (nivel II).
Aspiración
La aspiración broncopulmonar del contenido orofaríngeo está ligada a cualquier circunstancia que deprima el nivel de conciencia: accidente cerebrovascular (ACV), enfermedades degenerativas, traumatismos craneales, intoxicación por drogas, anestesia general, así como a situaciones que alteren la anatomía de la región laringofaríngea, como la intubación o la existencia de tumores35. La etiología suele ser polimicrobiana, con predominio de los anaerobios13 (nivel II).
Infección por el virus de la inmunodeficiencia humana
En estas circunstancias, la neumonía bacteriana es la infección más habitual, sobre todo la causada por S. pneumoniae, tanto en portadores del virus como en los afectados por el sida aunque, como ya se ha señalado, también son frecuentes otros agentes patógenos no habituales en la NAC (nivel II).
Tabaquismo
El consumo de tabaco se ha asociado a un incremento de NAC de cualquier etiología. Los fumadores tienen un riesgo 4 veces superior de presentar una enfermedad neumocócica invasiva que los no fumadores36 (nivel II). También es notable su asociación con NAC por C. pneumoniae13 y Legionella spp. 37 (nivel II).
Tratamientos crónicos con corticoides
El riesgo de infecciones respiratorias asociado a la corticoterapia crónica está relacionado con la dosis y con la enfermedad de base. Cantidades acumuladas de 700 mg de prednisona, o dosis mayores de 10 mg/día, incrementan la posibilidad de sufrir una infección. En un estudio español se aislaron Aspergillus spp. y S. aureus como patógenos más frecuentes en pacientes que estaban recibiendo este tratamiento38 (nivel II).
Factores ambientales y exposición laboral
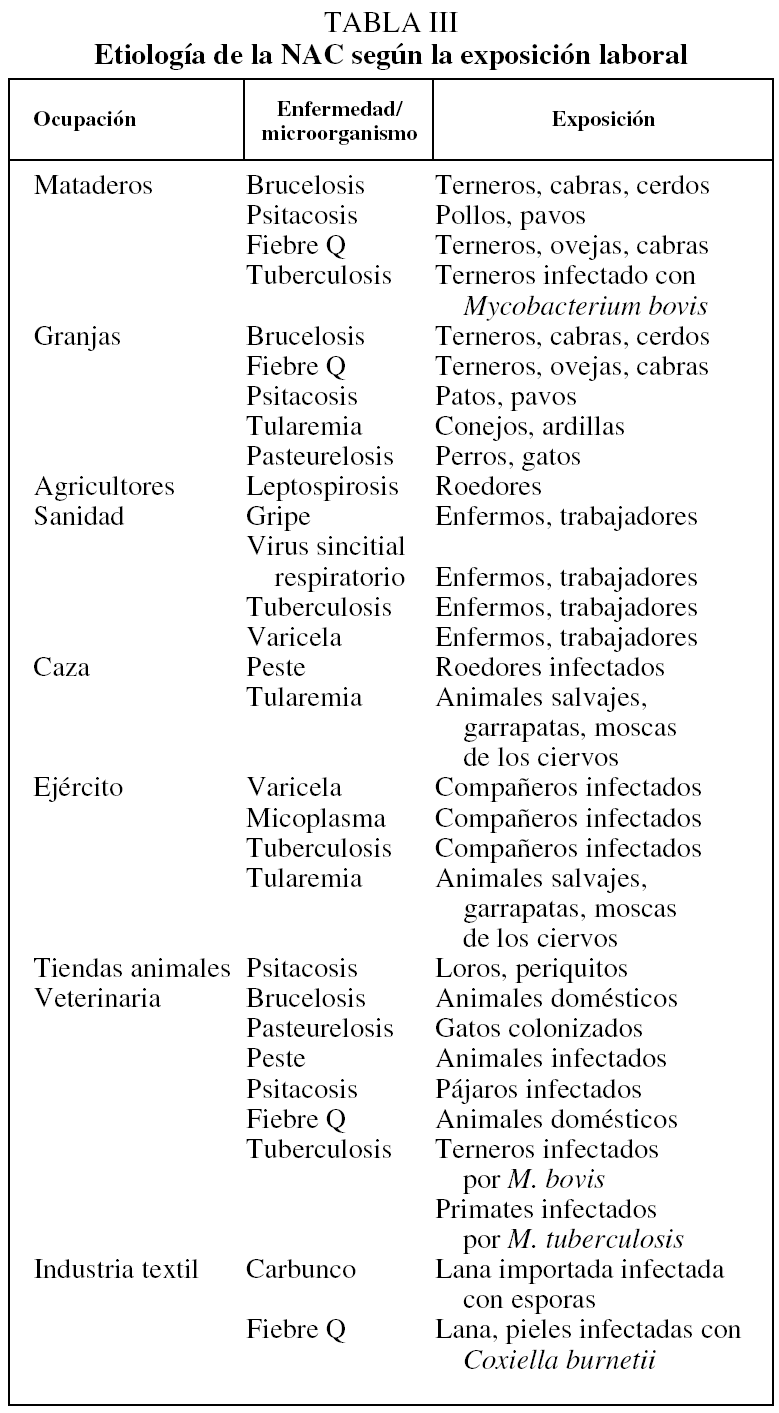
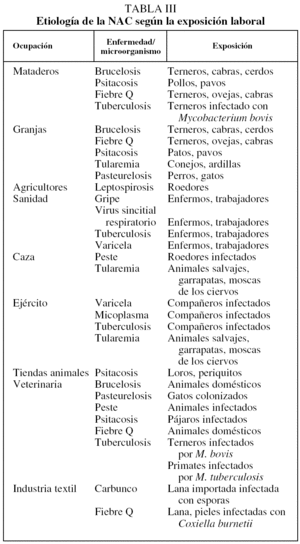
Una serie de circunstancias personales (aficiones, viajes) y de exposición laboral sugieren, en ocasiones, una determinada etiología, lo que supone una guía acerca de los métodos diagnósticos a emplear y permite seleccionar un tratamiento empírico más adecuado (tablas II y III) (nivel III).
Peculiaridades epidemiológicas en España
Legionella pneumophila
En España se ha descrito un incremento de la incidencia de NAC por Legionella spp., sobre todo en la zona mediterránea. Aunque la mayoría de los casos ocurre de forma aislada, han tenido lugar brotes de predominio estival que han afectado a un número significativo de personas. El origen más frecuente es la eliminación de aerosoles producidos por torres de refrigeración e instalaciones de agua caliente37,39 (nivel I).
Coxiella burnetii
Aunque tradicionalmente se ha considerado que Coxiella burnetii sólo era frecuente en la zona norte de España12,40, también ocupa un lugar preponderante en la etiología de la NAC en otras regiones4,8 (nivel II).
Chlamydophila psittaci
Es una zoonosis que se origina al inhalar restos orgánicos (heces, orina, plumas) o secreciones respiratorias que contienen el microorganismo. A pesar de que tradicionalmente se ha relacionado con aves (exóticas y de corral), otros animales pueden transmitir la enfermedad, por lo que su incidencia en zonas con actividad agrícola y ganadera, probablemente sea algo mayor de lo que se piensa. Aunque en otros países se han descrito epidemias en trabajadores de granjas o en veterinarios, en España sólo se han comunicado algunos brotes familiares que han afectado a un número muy limitado de personas con clínica variable41.
Manifestaciones clínicas
El diagnóstico sindrómico de NAC se basa en la existencia de una clínica de infección aguda acompañada de un infiltrado pulmonar de reciente aparición en la radiografía de tórax, no atribuible a otra causa (nivel III). Ante la dispar presentación clínica de la NAC se necesita conocer la epidemiología del área geográfica en la que se trabaja42. También puede ser útil, sobre todo en adultos jóvenes y sin enfermedades asociadas, la diferenciación entre cuadros clínicos «típicos» y «atípicos». El cuadro clínico «típico» se caracteriza por un comienzo brusco de menos de 48 h de evolución, escalofríos, fiebre mayor de 37,8 ºC, tos productiva, expectoración purulenta y dolor torácico de características pleuríticas. Paralelamente, los datos más significativos del cuadro clínico «atípico» son la tos no productiva, molestias torácicas inespecíficas y manifestaciones extrapulmonares (artromialgias, cefalea, alteración del estado de conciencia y trastornos gastrointestinales como vómitos y diarrea).
En cuanto a los datos complementarios, en la NAC se puede encontrar una leucocitosis (≥ 12.000/ µl) o una leucopenia (≤ 4.000/µl), una auscultación compatible con condensación pulmonar (que de forma aislada tiene una sensibilidad inferior al 40%)43, y un infiltrado que no existía previamente en la radiografía de tórax. Es importante recordar la disociación clinico-radiológica que ocurre en algunas neumonías de las conocidas como «atípicas», así como la aparición frecuente en neumonías por Legionella spp. de hiponatremia, hipofosfatemia y hematuria44-46. En las personas de edad avanzada no es infrecuente la presencia de confusión y agravamiento de enfermedades subyacentes, incluso en ausencia de fiebre.
Pruebas de laboratorio
El hemograma y la bioquímica elemental, así como la pulsioximetría o la gasometría arterial, recomendables en pacientes con NAC y enfermedad cardíaca o respiratoria asociada, deben realizarse en toda neumonía que llegue al hospital, para evaluar su gravedad y posible ingreso42 (nivel III).
Radiología torácica
Las manifestaciones clínicas de la NAC son inespecíficas, por lo que la radiografía de tórax es obligada para establecer su diagnóstico, localización y extensión, sus posibles complicaciones --como derrame pleural o cavitación--, y la existencia de enfermedades pulmonares asociadas, otros posibles diagnósticos alternativos, y también para confirmar su evolución hacia la progresión o la curación47. Sus limitaciones son la incapacidad para discriminar entre una neumonía y otros infiltrados inflamatorios no infecciosos y también para detectar pequeños infiltrados visibles por métodos más sensibles, como la tomografía computarizada (TC). La recomendación de realizar una radiografía de tórax de rutina en sus 2 proyecciones convencionales a los pacientes con sospecha de neumonía es universal42,43,48 (nivel II), y obligatoria tanto en los pacientes estudiados en el hospital, ingresen o no, como en los atendidos fuera de él, sobre todo si no hay mejoría clínica tras 48 h de tratamiento empírico49 (nivel III).
No hay ningún patrón radiológico que permita reconocer la etiología de la neumonía, ni siquiera diferenciar entre grupos de patógenos50 (nivel II). Los patrones clásicos (neumonía lobar, bronconeumonía y neumonía intersticial) no son exclusivos de ningún agente etiológico, aunque el reconocimiento de dichos patrones puede ser útil en ocasiones47,51 (nivel III). La afectación bilateral o de más de 2 lóbulos y la existencia de derrame pleural son indicadores de gravedad (nivel III), sobre todo el derrame pleural bilateral, sea por la propia neumonía o por insuficiencia cardíaca asociada6,52,53 (nivel II). La curación radiológica es casi siempre posterior a la clínica y en ocasiones puede tardar más de 8 semanas47 por lo que, aunque no es necesaria la práctica sistemática de una exploración radiológica previa al alta hospitalaria, sigue siendo imprescindible la confirmación radiológica de la curación de la neumonía.
Diagnóstico etiológico (tabla IV)
El diagnóstico etiológico no se puede obtener de forma fiable con los datos clinicorradiológicos (nivel II) y, aunque apliquemos las técnicas diagnósticas adecuadas en el ámbito hospitalario, sólo conseguiremos alcanzarlo en torno al 50% de los casos42. No existen estudios prospectivos que hayan identificado cuáles son las pruebas diagnósticas que deben aplicarse en la NAC43. Por otra parte, la ausencia de certeza de que el conocimiento del agente causal modifique el pronóstico ha producido discrepancias respecto de la necesidad de utilizarlas, aunque se ha sugerido que un diagnóstico etiológico precoz se correlaciona con una mejoría más rápida tras el inicio del tratamiento54, y que un antibiótico inadecuado está relacionado con mal pronóstico21,55. Así pues, se deben emplear más técnicas diagnósticas cuanto más graves sean las NAC, y pocas o ninguna en las NAC leves42,43,45,48,49,56,57 (nivel III). En cualquier caso, no debe retrasarse el inicio del tratamiento para la obtención de una muestra adecuada43. También deben utilizarse técnicas diagnósticas en los pacientes que no responden al tratamiento empírico y en las NAC de lenta resolución58 (nivel III).
La bacteria aislada en muestras respiratorias, salvo en caso de patógenos obligados como L. pneumophila o M. tuberculosis, puede actuar como colonizadora por lo que, para realizar el diagnóstico etiológico de certeza, se requerirá a menudo el aislamiento del microorganismo, o la detección de sus antígenos o de porciones específicas de su genoma en muestras no contaminadas como sangre, orina, líquido pleural o tejido pulmonar, o bien la detección sérica de anticuerpos específicos en valores significativos. Se podrá tener un diagnóstico de probabilidad en aislamientos respiratorios cuantificados o en determinadas condiciones (nivel II). Las diferentes técnicas microbiológicas de utilidad potencial en el diagnóstico etiológico de la NAC se pueden dividir en no invasivas e invasivas.
Técnicas diagnósticas no invasivas
Esputo
No existe un consenso claro sobre la recomendación de procesamiento microbiológico de muestras de esputo (tinción de Gram [TG], cultivo aerobio [Cul] y cultivo en BCYE para Legionella) en la NAC. Es difícil obtener muestras adecuadas que no estén muy contaminadas por secreciones orales, con menos de 10 células escamosas y más de 25 polimorfonucleares por campo a 100 aumentos (grados IV y V de Murray). En una serie prospectiva de NAC ingresadas en el hospital sólo un 39% de las muestras de esputo cumplían estos requisitos59, sin que se hayan descrito diferencias en la rentabilidad de la técnica en las diversas clases de riesgo de Fine60. Se recomienda efectuar TG y Cul en esputo reciente (debe ser transportado y procesado rápidamente, a poder ser en menos de 30 min [nivel II]), en muestras adecuadas y previo al inicio del tratamiento antibiótico en todas las NAC hospitalizadas (nivel II), en especial si se sospecha la presencia de un microorganismo resistente o inhabitual (nivel II). La TG puede guiar la terapia (nivel III), y el cultivo, si se correlaciona con TG, puede ser útil para conocer las posibles resistencias del patógeno a los antimicrobianos. El cultivo de esputo en medio adecuado para Legionella spp. es recomendable en brotes epidémicos, aun en el caso de positividad del antígeno urinario, ya que permitirá el diagnóstico de infecciones por serogrupos diferentes del 1 y por especies de Legionella distintas de L. pneumophila, así como relacionar, en el caso de estos brotes, las cepas clínicas con las ambientales mediante marcadores moleculares.
El esputo inducido es muy útil para el diagnóstico de M. tuberculosis o P. jiroveci en pacientes que no pueden expectorar, en casos de contexto epidemiológico y/o de inmunocompromiso que lo aconsejen43,48 (nivel I). La inmunofluorescencia directa (IFD) en secreciones respiratorias también puede emplearse en el diagnóstico de la NAC por Legionella spp., aunque su sensibilidad no supera el 50% en pacientes con expectoración suficiente. Emplea anticuerpos serotipoespecíficos, por lo que su rentabilidad dependerá de la especie de Legionella y los serotipos que se empleen.
Hemocultivo
La práctica de hemocultivos en la NAC tributaria de tratamiento ambulatorio no está justificada por su escasa rentabilidad61, y es discutida su relación coste-eficacia en las NAC que acuden al hospital62. Por el momento es prudente recomendar, sobre todo en casos graves, la extracción de 2 hemocultivos seriados en la NAC ingresada, que si son positivos tendrán valor, no sólo etiológico, sino también pronóstico42,43,48,49,57,63 (nivel II). Recientemente, y con objeto de racionalizar su empleo en la NAC, se ha propuesto la obtención de hemocultivos en función del riesgo de bacteriemia del paciente64.
Antigenuria para neumococo
Se realiza por inmunocromatografía, técnica rápida en la que la concentración de orina es un factor controvertido, aunque parece que la moderada pérdida de sensibilidad al usar orina directa (66%) se puede compensar por la simplificación y rapidez de la técnica, manteniendo una especificidad prácticamente del 100%18. En nuestro medio se considera razonable determinar la antigenuria neumocócica en orina no concentrada en casos de NAC que requieren ingreso hospitalario (nivel II). Se han descrito algunos casos de falsos positivos en pacientes con infecciones no neumocócicas por Streptococcus spp., así como la persistencia de su positividad varias semanas después de la resolución de la NAC65. La antigenuria neumocócica es complementaria a la TG en esputo si el paciente es capaz de expectorar adecuadamente, por lo que sería aconsejable la práctica conjunta de ambas técnicas66.
Antigenuria para Legionella
Su determinación mediante inmunocromatografía se ha convertido en el método diagnóstico de referencia en la legionelosis67; es fundamental, en este caso, la concentración y el tratamiento térmico de la orina para obtener una sensibilidad adecuada, pese a las 2-3 h de duración del proceso (nivel II). Probablemente, la ultracentrifugación de orina sea una alternativa válida, más rápida y sin pérdida de sensibilidad ni especificidad68 (nivel II). Se ha recomendado la práctica de antigenuria para Legionella en toda neumonía hospitalizada sin orientación diagnóstica inicial, tras TG de esputo o antigenuria neumocócica, en toda neumonía con criterios de gravedad, en neumonías con fallo terapéutico previo a betalactámicos, así como en todos los casos de NAC que coincidan con la sospecha de un brote comunitario epidémico de legionelosis43.
Líquido pleural
Aunque el rendimiento de la TG y el cultivo aerobio y anaerobio de líquido pleural es bajo, la práctica de una toracocentesis está recomendada ante un derrame pleural asociado a NAC, dado que la presencia de empiema inadvertido es uno de los factores asociados a fallo terapéutico en las primeras 48-72 h de ingreso hospitalario69. La determinación antigénica en muestras de líquido pleural puede proporcionar algunos diagnósticos adicionales a los obtenidos por métodos rutinarios (nivel III). La detección de antígeno neumocócico en el líquido pleural por inmunocromatografía de membrana (BINAX) se ha realizado con éxito, pero su uso no está aún estandarizado.
Serología
Habitualmente utilizada en el diagnóstico diferido de las neumonías causadas por agentes intracelulares, su utilidad clínica es muy limitada, por lo que no se recomienda su uso en la práctica habitual (nivel III), salvo en situaciones excepcionales, como ante sospecha de brote comunitario de legionelosis o neumonía tularémica, o en estudios de interés epidemiológico. La determinación de IgM no ofrece una sensibilidad ni una especificidad suficientemente adecuadas para recomendar su uso rutinario70. Incluso en los estudios serológicos más clásicos con IgG surgen dudas razonables sobre su especificidad para algunos agentes como C. pneumoniae y Le spp.71.
Reacción en cadena de la polimerasa (PCR) en muestras no invasivas
Las técnicas de PCR para identificar porciones de ADN de patógenos productores de NAC en muestras biológicas como esputo, sangre, líquido pleural u orina están fuera de la práctica clínica habitual en la mayoría de los centros de nuestro medio y ofrecen problemas en la valoración de su valor predictivo tanto positivo como negativo72, por lo que no se puede recomendar su uso rutinario (nivel III). No obstante, es aconsejable profundizar en su conocimiento en centros con infraestructura técnica y disponibilidad para su realización16.
Técnicas invasivas
Sólo están indicadC más graves, de curso fulminante o que no responden al tratamiento antibiótico empírico inicial42,43,48,49 (tabla 4), pese a que hay datos que apuntan a que el pronóstico de la NAC grave niagnóstico etiológico23,73. Las técnicas diagnósticas invasivas son la aspiración transtraqueal, la punción-aspiración con aguja fina (PAAF) transtorácica y las técnicas realizadas mediante fibrobroncoscopio como el cepillo telescopado protegido (CTP) y el lavado broncoalveolar (LBA). Todas ellas debe realizarlas personal experto (nivel III).
Técnicas no broncoscópicas
La aspiración transtraqueal no se utiliza actualmente. La PAAF transtorácica permite recoger muestras del parénquima pulmonar no contaminadas, con elevada especificidad (90%), aunque su sensibilidad no es alta y es muy variable entre las diferentes series (34-82%), incluso en manos expertas. Complementando el cultivo con técnicas para la detección de antígenos del neumococo o bien de amplificación génica en la muestra, la sensibilidad mejora significativamente74 (nivel II). A pesar de que es más sensible la PCR que el látex, se utiliza más este último por tener una mejor relación coste-beneficio, y por ser más rápido, sencillo y ventajoso para la elección de la terapia inicial74,75 (nivel II). La PAAF puede plantearse en la NAC abcesificada o que no responde al tratamiento; sus 2 complicaciones más graves son el neumotórax (2-5%) y la hemoptisis (2-5%). La biopsia pulmonar a cielo abierto es la técnica más invasiva y su uso es excepcional, ya que en pocas ocasiones proporciona información relevante en pacientes inmunocompetentes con NAC.
Técnicas broncoscópicas
Numerosos estudios han demostrado que estas técnicas pueden dar una información microbiológica útil, no sólo en la neumonía asociada al ventilador, sino también en la NAC76. La mejor sensibilidad se obtiene con los cultivos cuantitativos del LBA y la mejor especificidad con los cultivos cuantitativos del CTP.
Para diferenciar colonización de infección en el CTP se utiliza el punto de corte de 10³ ufc/ml (unidades formadoras de colonias por ml). La sensibilidad del CTP es variable (54-85%) y su especificidad bastante alta (superior al 85%), pero ambas se influencian por la antibioterapia previa, de tal forma que la realización de la prueba transcurridas 12 h desde el inicio de la antibioterapia, puede influir negativamente en el número de microorganismos aislados y el porcentaje de resultados positivos de la técnica77 (nivel II).
En las NAC de evolución tórpida el LBA parece ser la técnica diagnóstica de elección, pues permitirá diagnosticar infecciones no sospechadas con mayor probabilidad que otras técnicas58. En las NAC que no responden al tratamiento antibiótico empírico se recomienda tomar muestras con CTP y LBA antes de los cambios terapéuticos, para no enmascarar la presencia de patógenos inusuales, resistentes o persistentes.
Escalas pronósticas y decisión de ingreso hospitalario
La valoración inicial de la gravedad de la NAC mediante factores pronósticos se realiza tanto para decidir la ubicación más apropiada donde atender al paciente --ambulatorio, ingreso hospitalario o cuidados intensivos--, como para establecer el tratamiento antibiótico empírico más adecuado. Los múltiples factores asociados con mayor morbimortalidad se enunciaron en un metaanálisis clásico, donde se clasificaron en: a) dependientes del paciente, como la edad y enfermedades asociadas, y b) dependientes del episodio de NAC, como los hallazgos clínicos, analíticos y radiográficos6. Ningún factor pronóstico aislado es capaz de predecir la defunción con suficiente sensibilidad o especificidad, por lo que debemos recurrir a estudios multivariados, que ofrecen la posibilidad de obtener factores de riesgo independientes y de valor pronóstico79.
En la última década han aparecido estudios que proporcionan escalas pronósticas capaces de estimar la probabilidad de muerte de un paciente con NAC. Su objetivo va dirigido a 2 aspectos fundamentales en el manejo de la NAC: 1) identificar pacientes con bajo riesgo de muerte, que podrían tratarse en un ámbito extrahospitalario, y 2) reconocer pacientes con alto riesgo de muerte, que deben ingresar80.
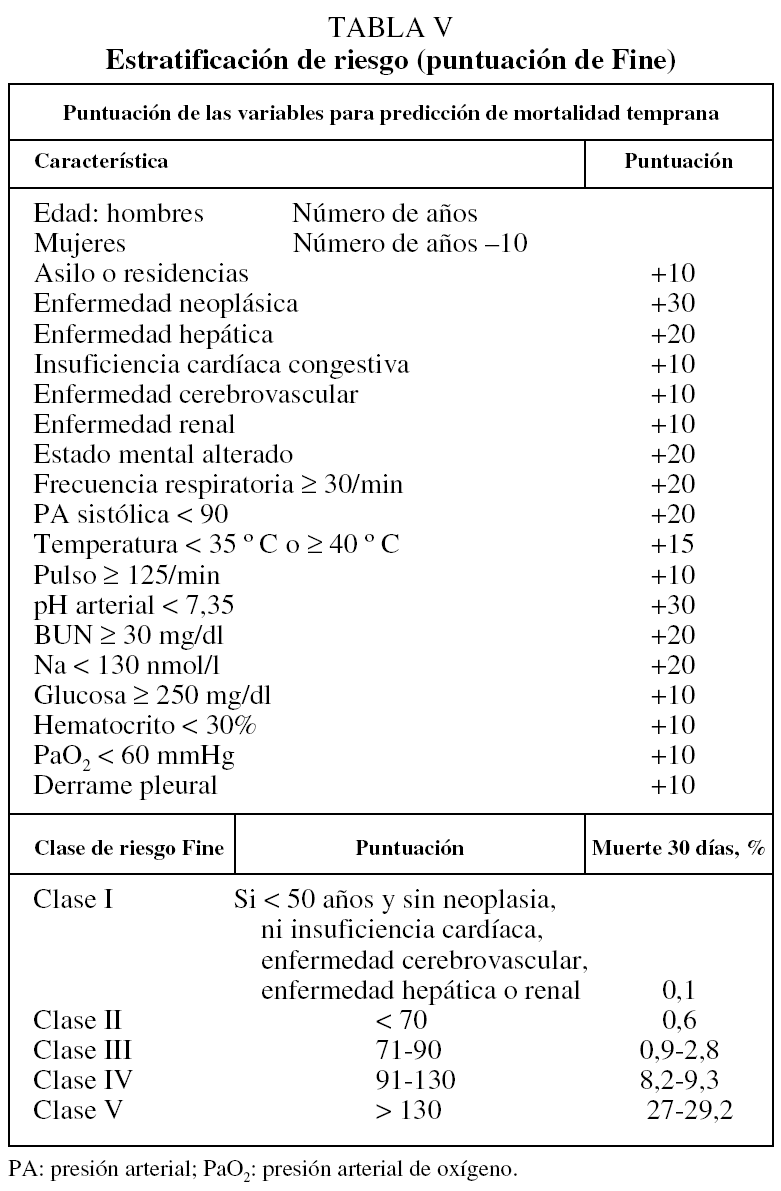
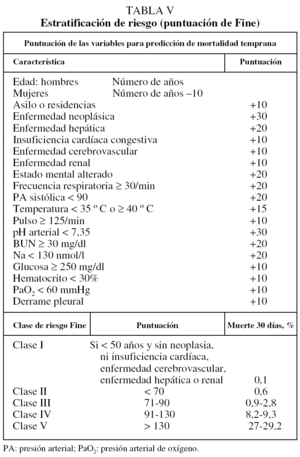
Fine et al81, mediante modelos basados en estudios estadísticos multivariados, han obtenido una escala pronóstica que estratifica a los pacientes en 5 grupos según su riesgo de defunción (clase de riesgo de Fine o PSI [pneumonia severity index]). Esta escala deriva del estudio multicéntrico llevado a cabo en Estados Unidos en 14.199 pacientes con NAC, y ha sido validada en una cohorte independiente de pacientes (PORT). Para la predicción de mortalidad combina 20 variables con una asignación de puntos que permite estratificar a los pacientes en 5 categorías (tabla 5): clases I-III (con riesgo de muerte bajo, entre 0,1-2,8%), clase IV (riesgo de muerte entre 8,2-9,3%) y clase V (riesgo de muerte elevado, entre 27-31%). Al identificar pacientes con una probabilidad de muerte < 3% (clases de riesgo I-III) esta escala se ha convertido en una herramienta para la decisión de tratamiento ambulatorio. Las clases I y II recibirán tratamiento ambulatorio, la clase III precisará hospitalización en observación, y las clases IV y V ingreso en el hospital81.
Aplicada a diferentes poblaciones, se ha comprobado que esta escala clasifica de forma muy precisa la probabilidad de muerte, sobre todo en personas mayores de 65 años, aunque su valor predictivo de ingreso hospitalario es menor. Entre sus limitaciones destaca que requiere 20 variables para su cálculo, algunas de ellas obtenidas de análisis disponibles sólo en hospitales, y que puede infravalorar la gravedad en sujetos jóvenes. Por otra parte, no tiene en cuenta factores sociales o circunstancias personales de los pacientes que pueden ser importantes a la hora de decidir el ingreso en el hospital.
Los estudios prospectivos realizados para verificar su utilidad en la decisión de ingreso han corroborado que el empleo de la escala de Fine reduce la proporción de ingresos en las clases de riesgo bajas, pero aumenta la proporción de reingresos en las siguientes 4 semanas82,83.
Las causas de ingreso hospitalario en las clases con riesgo bajo de muerte son múltiples. En un estudio observacional se concluye que la escala del PSI tiene un valor predictivo positivo bajo para evaluar la hospitalización inadecuada, ya que no detecta bien la gravedad de las enfermedades asociadas o de las circunstancias sociales en la NAC no grave84 (encuentran necesidad de ingreso en escalas bajas en el 43% de los casos por necesidades sociales, en el 18% debido a intolerancia a la medicación oral, en un 14% por fracaso terapéutico previo, y en el 9% por sospecha de sepsis). En nuestro medio, se ha descrito la insuficiencia respiratoria y las complicaciones pleurales como causas frecuentes de ingreso hospitalario de NAC y de mayor duración de hospitalización en clases de riesgo de Fine bajas15,85. Asimismo, tras validar la escala de Fine para predecir la mortalidad, se ha propuesto incluir factores adicionales para mejorar la seguridad de la predicción del ingreso86. De hecho, se ha comunicado que hasta el 27% de los pacientes ingresados en la UCI por NAC tiene un PSI de bajo riesgo (I-III)87.
La British Thoracic Society (BTS) también confeccionó una escala pronóstica que posteriormente se simplificó, utilizando sólo 4 variables y la edad: CURB65, acrónimo de confusión, urea (> 7 mml/l), frecuencia respiratoria (≥ 30 rpm) y presión arterial (PA) (diastólica ≤ 60 mmHg o sistólica < 90), y edad (≥ 65 años)88. Esta escala, obtenida en un estudio de cohortes de 1.068 pacientes, estratifica acertadamente a los pacientes según su probabilidad de muerte. La valoración de la confusión se puede realizar, según recomienda la BTS, con un cuestionario de 10 preguntas, o de forma reducida, mediante la valoración de la aparición de desorientación en tiempo, espacio o personal. El cálculo de la puntuación se realiza sumando un punto por cada variable presente con un rango entre 0-5.
La probabilidad de muerte para cada valor en la cohorte de derivación es la siguiente: puntuación 0 = 0,7%, 1 = 2,1%, 2 = 9,2%, 3 = 14,5%, ≥ 4 = 40%, y se aconseja el ingreso hospitalario cuando el valor de la puntuación es igual o superior a 1, sobre todo si existen otros factores de gravedad como hipoxemia o afectación multilobar de la neumonía. Además, en el mismo estudio se valida una simplificación de la escala, excluyendo el valor de la urea para su aplicación en el ámbito de la asistencia primaria. Es el denominado CRB65, con un rango de puntuación entre 0-4, y cuya probabilidad de muerte para cada valor es el siguiente: puntuación 0 mortalidad 1,2%, valor 1-2: 8,5% y valor 3-4: 31%88.
Dado que con la información actualmente disponible ninguna escala pronóstica presenta unos valores predictivos incuestionables para definir el riesgo de muerte, en la decisión de ingreso hospitalario debe prevalecer el juicio clínico y la individualización ante cada paciente. En general, se considera que la escala de Fine es más útil para detectar enfermos de bajo riesgo de mortalidad, y la CURB65 para los de riesgo más elevado.
Las últimas recomendaciones de la Infectious Diseases Society of America (IDSA) establecen una estrategia en 3 pasos para decidir el lugar de atención al paciente con NAC43. En el primer paso se valora la existencia de alguna condición que comprometa la seguridad de la atención domiciliaria, como la insuficiencia respiratoria, problemas sociales o psiquiátricos, abuso de drogas o alcohol, e incapacidad de tratamiento oral. En segundo lugar, tras descartar los anteriores supuestos, se calcula la clase de riesgo de Fine. El último paso hace referencia al juicio clínico para individualizar la aplicación de la clase de riesgo de Fine. En la actualidad, existen otras opciones de atención al paciente con NAC que se deben valorar, como hospitalización domiciliaria, hospitales de día o admisión en un servicio de observación, respecto a los cuales no hay estudios específicos.
La adopción de unos criterios homogéneos para derivar un paciente con NAC a UCI es difícil y depende de diversos factores. La amplia variación en el porcentaje de NAC ingresadas en las UCI entre distintos hospitales (8,8-26%) pone de manifiesto la dificultad de homogeneizar estos criterios87. La valoración clínica de la gravedad no es fácil, con tendencia a subestimarla80, y tampoco existe una definición clara de neumonía grave (NACG). La indicación de ventilación mecánica es un criterio más homogéneo y se ajusta más a la gravedad de la enfermedad del paciente que a la variabilidad entre hospitales87.
Los criterios iniciales de la SEPAR consideraban el ingreso en UCI ante la presencia de una o varias de estas 6 complicaciones: insuficiencia respiratoria grave, inestabilidad hemodinámica, fracaso renal que obligue a diálisis, coagulación intravascular diseminada, meningitis o coma (nivel III)45. Las normativas previas de la American Thoracic Society (ATS), BTS y PSI proponen diversos criterios para el ingreso en UCI pero su poder de discriminación es bajo89. Para mejorarlo se propuso emplear una fórmula reducida a 5 factores clasificados como 2 criterios mayores (necesidad de ventilación mecánica y shock séptico) y 3 menores (PA sistólica < 90, afectación multilobar y PaO2/FiO2 < 250). La existencia de 2 criterios menores o 1 mayor sería indicación de ingreso en UCI, lo que aumenta la especificidad al 94% y mantiene una sensibilidad del 78%90. Aunque esta fórmula tiene un valor predictivo relativamente bajo87, es superior a los resultados obtenidos con las antiguas recomendaciones de la ATS, de la BTS y el PSI. La escala británica CURB-65 también puede emplearse para decidir el ingreso en UCI cuando la puntuación es > 3. Su validación en casos de NACG, considerando como tal la presencia de 2 o más de las alteraciones reflejadas en el acrónimo, tiene una sensibilidad del 82% y una especificidad del 73% para predecir muerte o necesidad de UCI91,92.
El impacto de las enfermedades asociadas en las NAC que ingresan en UCI no es suficientemente conocido. Se ha descrito que la presencia de neoplasias, enfermedades neurológicas o cardiológicas puede ser la causa de la muerte hasta en el 47% de los pacientes con NACG93. La EPOC sólo repercute de forma significativa en la mortalidad de la NACG cuando se asocia a oxigenoterapia domiciliaria. Por el contrario, otros factores sí lo hacen, como la extensión de la lesión, el fracaso de otros órganos, la inmunosupresión o la edad muy avanzada94.
La disponibilidad de unidades de cuidados intermedios y el uso de la ventilación mecánica no invasiva (VMNI) en las NACG puede influir en la ubicación del paciente al permitir otras opciones terapéuticas con tasas inferiores de infección nosocomial y menores costes.
Tratamiento de la NAC
El tratamiento antimicrobiano (ATM) de un paciente con NAC se establece de forma empírica, tras valorar la gravedad del cuadro, la etiología más probable y la prevalencia de las resistencias de los microorganismos más frecuentes en nuestra área95. Después de considerar estos factores, se establece cuál es el tratamiento empírico más adecuado frente a los microorganismos más probablemente implicados (niveles II y III). En nuestro país, según los últimos estudios, se mantienen unos valores de S. pneumoniae con sensibilidad disminuida a la penicilina entre 35 y 50%, y las resistencias de alto grado han disminuido. La presencia de determinados factores hace sospechar la posible existencia de neumococos con sensibilidad disminuida a betalactámicos: pacientes mayores de 65 años, con enfermedad pulmonar crónica, alcohólicos, inmunodeprimidos, con múltiples enfermedades asociadas, en contacto con niños en guarderías, que han recibido tratamiento con betalactámicos en los últimos 3 meses o que han estado ingresados en el hospital. La resistencia a macrólidos se sitúa en nuestro país en torno al 25-40%42,96,97.
Se han descrito 2 tipos de resistencia a los macrólidos: una de alto nivel (CIM a eritromicina igual o superior a 16 µg/ml), por alteraciones del ARN ribosomal, que afecta a todos los macrólidos y es insensible al incremento de las dosis; y otra de bajo nivel (CIM entre 1 y 8 µg/ml), relacionada con un incremento de la actividad de la bomba de eflujo citoplasmático, que afecta sólo a las moléculas de macrólidos de 14 y 15 átomos de carbono. Esta última es minoritaria en España, y se vence al incrementar las dosis42,96,97. Se han descrito varios factores que sugieren la posible resistencia del neumococo a las fluoroquinolonas: presencia de EPOC, origen nosocomial de la infección, residencia en asilo de ancianos y exposición previa a fluoroquinolonas98-100; se desaconseja la monoterapia empírica con fluoroquinolonas en pacientes inmunodeprimidos tratados con estos antibióticos en los 4 meses previos101.
La carencia de estudios aleatorizados con un número importante de pacientes con NAC tratados con los diferentes antibióticos hace que haya una pobre evidencia para sustentar las recomendaciones sobre el ATM. En cualquier caso, la antibioterapia ha de iniciarse precozmente, antes de que transcurran 4 h desde el diagnóstico de la NAC, lo que reduce tanto la mortalidad como la estancia hospitalaria43,102,103 (nivel II). Hay que considerar también que una vez instaurado el tratamiento hay que hacer una revaluación clínica a las 24-48 h.
Los pacientes del grupo 1 sufren cuadros leves de NAC que pueden ser tratados de forma ambulatoria. En estas circunstancias, el cuadro clínico no es grave y el tratamiento ATM debe dirigirse fundamentalmente a tratar el neumococo. Dado el incremento de la prevalencia de cepas de neumococo con sensibilidad disminuida a la penicilina y a los macrólidos, y la necesidad de cubrir en muchos casos microorganismos atípicos (pacientes jóvenes, en determinadas situaciones epidémicas o con clínica altamente sugestiva), se recomienda el tratamiento de los enfermos de este grupo con telitromicina oral, 800 mg/día, o bien con algunas de las nuevas fluoroquinolonas, como levofloxacino oral, 500 mg/día, o moxifloxacino oral, 400 mg/día. Otra posibilidad es el uso de amoxicilina oral a dosis altas (al menos 1 g cada 8 h), que son efectivas contra la mayoría de las cepas neumocócicas con sensibilidad disminuida a betalactámicos, acompañada de un macrólido: azitromicina oral, 500 mg al día, o claritromicina oral, 500 mg cada 12 h. Dada la elevada tasa de resistencias de los neumococos frente a los macrólidos en nuestro país, y el mecanismo predominante, no se considera aconsejable la monoterapia con macrólidos.
Existe un subgrupo de pacientes que pueden ser tratados de forma ambulatoria pero que tienen enfermedades crónicas asociadas u otros factores de riesgo de etiología no habitual (H. influenzae, enterobacterias). En estos casos, el tratamiento de elección sería una fluoroquinolona antineumocócica (levofloxacino o moxifloxacino) en monoterapia por vía oral. Como alternativa podría emplearse amoxicilina-ácido clavulánico, siempre teniendo en cuenta su falta de actividad frente a los microorganismos atípicos.
Los pacientes del grupo 2 son aquellos en los que se ha decidido su hospitalización por motivos clínicos. El S. pneumoniae sigue siendo el patógeno causal más frecuente, pero la probabilidad de que el paciente tenga factores asociados a un mayor riesgo de neumococo resistente a antimicrobianos o BGN entéricos (pacientes con enfermedad cardiopulmonar previa u otras enfermedades asociadas, o que han recibido antibioterapia en los últimos 3 meses) es alta. Los patógenos atípicos, incluida Legionella spp., pueden estar implicados en aproximadamente el 20% de las neumonías con etiología definida. Así pues, en estas circunstancias, el tratamiento empírico inicial debe incluir cualquiera de los siguientes regímenes: cefalosporina de tercera generación (1 g/6 h de cefotaxima o 1-2 g/24 h de ceftriaxona por vía intravenosa) o 1.000/200 mg/8 h de amoxicilina-ácido clavulánico por vía intravenosa, asociados a un macrólido por la misma vía.
En muchos pacientes se podrá utilizar la vía oral con combinaciones que incluyan un macrólido y amoxicilina con ácido clavulánico oral, 2.000/125 mg/12 h. Si la antigenuria de L. pneumophila es negativa, se podría prescindir del macrólido y realizar monoterapia con betalactámicos, aunque se ha sugerido que la combinación de un betalactámico con un macrólido es superior a la administración del betalactámico solo, ya que disminuye la mortalidad de la NAC, sobre todo en los pacientes bacteriémicos104-106. Éste es un aspecto polémico que precisa de estudios aleatorizados que lo respalden (nivel II). Otra posibilidad terapéutica igualmente válida podría ser utilizar una fluoroquinolona antineumocócica (levofloxacino o moxifloxacino)107-109 (nivel II), ya que se ha descrito que su uso es un factor predictivo de menor fallo terapéutico, que justificaría su administración en estos casos de NAC110.
Los pacientes que presentan un cuadro inicial muy grave que requiere su ingreso en UCI constituyen un conjunto más seleccionado y homogéneo (grupo 3) que se debe tratar con una cefalosporina de tercera generación a dosis altas (cefotaxima por vía intravenosa, 2 g/6-8 h; ceftriaxona por vía intravenosa, 2 g/24 h), siempre asociada a un macrólido (claritromicina por vía intravenosa, 500 mg/12 h, azitromicina por vía intravenosa, 500 mg/día), o a una fluoroquinolona antineumocócica (levofloxacino por vía intravenosa, 500 mg/día).
Si existen factores de riesgo para infección por P. aeruginosa (antibioterapia de amplio espectro durante más de 7 días en el último mes, presencia de bronquiectasias, malnutrición o enfermedades o tratamientos asociados a disfunción de los neutrófilos)31, se debe tratar al paciente con terapia combinada frente a este patógeno, sin olvidar la cobertura frente a neumococo potencialmente resistente y Legionella spp. Esto se puede conseguir con una cefalosporina de cuarta generación (cefepima por vía intravenosa, 1-2 g/12 h), piperacilina-tazobactam (4.000/500 mg/8 h), imipenem o meropenem (0,5-1 g/6-8 h), asociado a una fluoroquinolona todos por vía intravenosa: ciprofloxacino, 400 mg/8 h, o bien levofloxacino, 500 mg/12 h. Para algunos autores111, la asociación carbapenem-fluoroquinolona debería evitarse por la posibilidad de que se induzcan resistencias cruzadas. Otra alternativa podría ser la combinación de un betalactámico más un aminoglucósido (preferiblemente tobramicina o amikacina), basada en el efecto sinérgico de ambos antibióticos que contrapesaría la escasa penetración pulmonar de los aminoglucósidos.
Cuando se sospeche una infección por anaerobios (necrosis o cavitación en la radiografía de tórax, o bien sospecha de aspiración), se debe administrar amoxicilina-ácido clavulánico, con altas dosis de amoxicilina (2 g) y, como alternativa, clindamicina asociada a una cefalosporina de tercera generación, o bien ertapenem o moxifloxacino en monoterapia; si es necesario el ingreso en UCI, sería recomendable sustituir la cefalosporina por la asociación piperacilina-tazobactam.
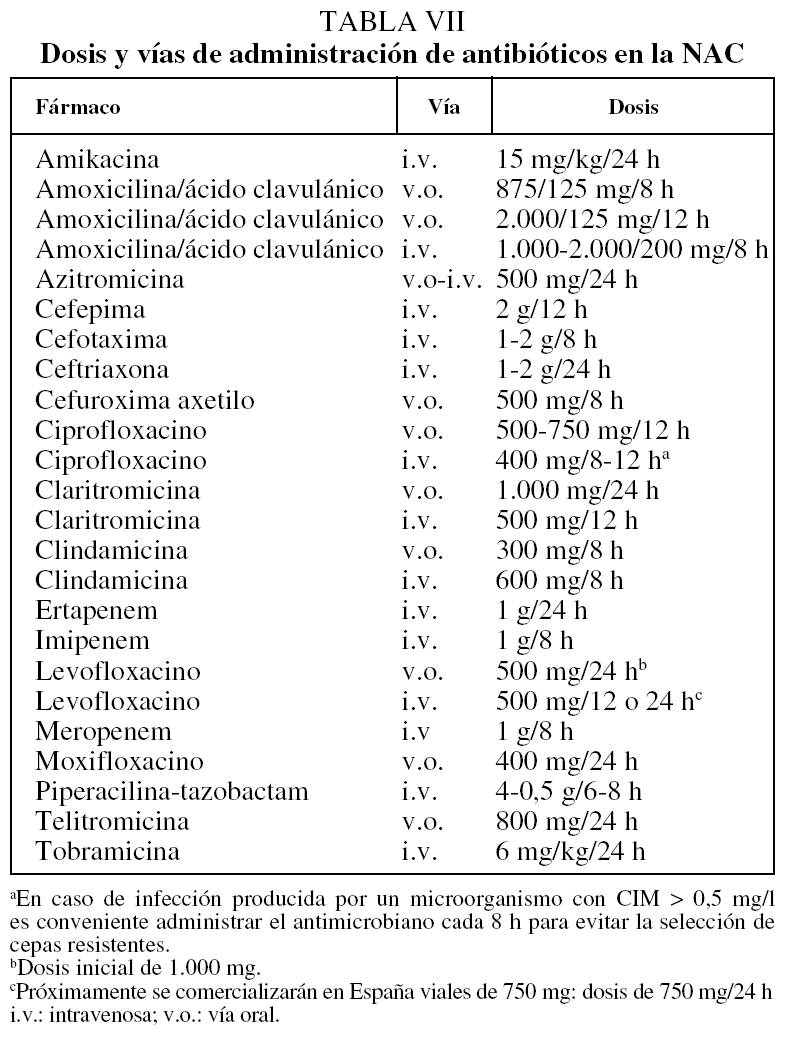
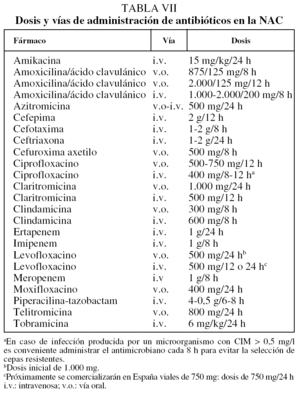
En las tablas VI y VII se muestran las pautas de tratamiento y las dosis recomendadas.
La aceleración del paso del tratamiento inicial parenteral a la vía oral (terapia secuencial) en el ATM de un paciente con NAC es muy importante para intentar reducir la estancia media hospitalaria y el coste económico, sin comprometer la seguridad de los pacientes. Cuando está indicado, la duración mínima del ATM empírico parenteral debe ser de 2 a 4 días, tiempo requerido para alcanzar la estabilización de la NAC en la mayoría de los casos112-114. Los criterios de terapia secuencial son: capacidad para la ingesta oral, ausencia de fiebre (< 37,8 ºC), mejoría o resolución de los síntomas y signos de neumonía, estabilidad hemodinámica, y ausencia de confusión mental o de comorbilidades inestables, metástasis sépticas u otras infecciones activas112,113,115 (nivel II). El alta hospitalaria se podría dar a las 24 h de alcanzar la estabilidad clínica.
La duración del tratamiento antibiótico es difícil de establecer. Habitualmente, las NAC se tratan durante 10 a 14 días, aunque se está intentando aplicar unas pautas más cortas (5 a 7 días) con los nuevos antibióticos, de vida media más larga, para intentar conseguir unos resultados clínicos y bacteriológicos similares con menor consumo de fármacos, favoreciendo una mejor cumplimentación y posibilitando la disminución de resistencias116,117 (nivel III). Ante la falta de más estudios que aconsejen un tratamiento más corto, los pacientes deberán recibir ATB de 7 a 10 días en las NAC que no requieren ingreso y de 10 a 14 días en las NAC que sí que lo necesitan118. En general, la duración del tratamiento también vendrá condicionada por la gravedad del cuadro, la existencia de enfermedades basales, la presencia de bacteriemia, la evolución y el agente etiológico responsable: no será inferior a 14 días en las NAC debidas a L. pneumophila, S. aureus o P. aeruginosa, y puede llegar a las 4 semanas en los casos con cavitación pulmonar con sospecha de infección por anaerobios112 (nivel II).
En todos los pacientes con NAC habría que seguir una serie de medidas generales, como hacer reposo y beber abundantes líquidos para mantener una correcta hidratación, así como administrar antitérmicos para disminuir la fiebre y analgésicos ante la presencia de dolor torácico. En pacientes con NAC grave habría que emplear medidas de soporte, como oxigenoterapia (su objetivo es mantener una saturación arterial de oxígeno ≥ 90% o presión arterial de oxígeno ≥ 60 mmHg), ventilación mecánica en caso de insuficiencia respiratoria aguda grave, junto con reposición de líquidos y/o aminas presoras para mantener la tensión arterial adecuada.
El uso de VMNI en NACG ha demostrado una mejoría de la insuficiencia respiratoria, un descenso de la tasa de intubación orotraqueal y un acortamiento de la estancia en UCI119 (nivel I), aunque este beneficio terapéutico sólo aparece en el subgrupo de pacientes con EPOC. Otros estudios encuentran que, aunque la VMNI mejora inicialmente la oxigenación en la NACG, se requiere la intubación posterior en el 66% de los pacientes120 (nivel III).
En los pacientes con NACG que coexiste con EPOC, dado el gran número de complicaciones y su mal pronóstico si precisan intubación orotraqueal, se prefiere utilizar inicialmente la VMNI. En los pacientes con NACG que cursan con insuficiencia respiratoria hipoxémica, la VMNI se asoció a una reducción significativa de la necesidad de intubación endotraqueal y de la mortalidad a los 30 días en comparación con la oxigenoterapia inicial con altas fracciones inspiratorias de oxígeno, por lo que se recomienda una prueba terapéutica inicial con VMNI, con vigilancia estricta de los indicadores de su fracaso121,122. En los pacientes de riesgo se recomienda efectuar una evaluación cuidadosa al ingreso con cualquiera de las reglas pronósticas y una revaluación frecuente, con objeto de detectar precozmente el deterioro de la situación clínica u oximétrica. La necesidad de aumentar la FiO2, la alteración del estado mental y el inicio de una acidosis respiratoria o metabólica son indicadores de la necesidad de cuidados intensivos en estos enfermos.
NAC de mala evolución
Entre un 10 y un 25% de los pacientes con NAC tienen una evolución insatisfactoria (no respondedores). Entre ellos se incluyen aquellos con retraso o ausencia de mejoría de la sintomatología general, así como las NAC en que prosigue el deterioro a pesar del ATB55. Las causas de esta falta de respuesta pueden ser diversas (tabla VIII)123,124.
Ante un paciente que no responde se debe hacer una revaluación completa, tanto de la anamnesis como de los resultados microbiológicos iniciales, así como una nueva evaluación microbiológica, con técnicas no invasivas e incluso invasivas a través del broncoscopio flexible, complementadas por el empleo de otras técnicas como la TC torácica, que pueden ser básicas para determinar el cambio subsiguiente de tratamiento antibiótico (nivel III).
Prevención de la NAC
La prevención de la NAC se puede efectuar mediante la lucha contra los patógenos que la causan, cuyo prototipo sería la vacunación específica contra el neumococo, o bien intentando suprimir las condiciones de riesgo que favorecen la presentaantigripal y la lucha contra el tabaquismo.
Vacuna neumocócica
En la actual 23-valente, que contiene los polisacáridos capsulares purificados de 23 serotipos causantes del 85-96% de las infecciones neumocócicas en niños y adultos125, y es efectiva para prevenir la enfermedad neumocócica invasiva (bacteriemia, meningitis o infección de cualquier lugar estéril), provocada por los serotipos antes mencionados, y la vacuna heptavalente-conjugada, que protege contra los 7 serotipos que causan la mayoría de las otitis media, neumonía y meningitis en niños.
La vacuna antineumocócica provoca una respuesta humoral que disminuye a partir de los 5-10 años de la vacunación. Después de su administración produce leves efectos secundarios locales en la mitad de los casos, y rara vez fiebre.
Recomendaciones de utilización vacuna polisacárida 23-valente
1. Edad superior a 65 años.
2. Personas con edades comprendidas entre los 2 y los 65 años:
- Enfermedad pulmonar o cardíaca crónica.
- Diabetes mellitus.
- Alcoholismo, enfermedad hepática crónica.
- Asplenia funcional o anatómica.
3. Pacientes inmunodeprimidos mayores de 2 años:
- Infección por virus de la inmunodeficiencia humana (VIH).
- Inmunodeficiencias congénitas.
- Síndrome nefrótico e insuficiencia renal.
- Tratamiento inmunosupresor (incluido los trasplantados).
Recomendaciones de utilización de la vacuna conjugada
1. Edad: menor de 23 meses.
2. Personas entre 24 y 59 años:
- Anemia de células falciformes, asplenia congénita o adquirida, disfunción esplénica.
- Infección por el VIH.
- Situaciones de inmunosupresión:
- Inmunodeficiencias congénitas.
- Síndrome nefrótico e insuficiencia renal.
- Tratamiento inmunosupresor (incluido los trasplantados).
- Enfermedades crónicas (cardíaca, pulmonar, diabetes mellitus).
La vacuna polisacárida 23-valente no debería administrarse durante la infección neumocócica aguda, y tampoco se recomienda durante el embarazo ni la lactancia. En pacientes inmunodeprimidos es menos efectiva, aunque algunas sociedades científicas recomiendan su utilización en estos casos, e incluso aconsejan la revacunación a los 5 años. También se recomienda administrar una segunda dosis de la vacuna a los pacientes de más de 65 años que recibieron la primera vacuna durante los 5 años previos y, además, en ese momento eran menores de 65 años, aunque la revacunación está formalmente contraindicada antes de haber pasado 3 años, debido a las posibles reacciones graves que pueden ocurrir por los altos valores circulantes de anticuerpos (nivel III). En los demás supuestos no se aconseja la revacunación, excepto en los casos de asplenia en mayores de 10 años. La vacuna antineumocócica puede administrarse simultáneamente con otras vacunas como la de la gripe, pero en lugar distinto126,127 (nivel I).
Vacuna antigripal
En España la epidemia gripal ocurre en la época invernal; afecta al 1-5% de la población y al 40-50% de las personas mayores de 65 años. La vacuna antigripal ha demostrado ser efectiva para prevenir o atenuar la enfermedad viral, tanto en ancianos como en jóvenes. Su eficacia depende de la similitud entre la secuencia viral circulante y la de la vacuna administrada128,129, y puede llegar a prevenir la enfermedad en el 70-90% de las personas sanas menores de 65 años. En sujetos mayores o con enfermedades crónicas debilitantes la eficacia es menor, pero puede atenuar la enfermedad producida por el virus de la influenza, provocando menos infecciones del tracto respiratorio inferior y disminuyendo la morbiripal.
Recomendaciones prioritarias de vacunación antigripal130
1. Población con riesgo elevado de complicaciones:
- Edad: ≥ 65 años.
- Adultos y niños con enfermedades pulmonares o cardiovasculares, incluida el asma.
- Personas internadas en instituciones cerradas.
- Adultos y niños sometidos a vigilancia médica u hospitalización durante el año anterior a causa de enfermedades crónicas metabólicas (incluida la diabetes mellitus), disfunción renal, hemoglobinopatías o estados de inmunodeficiencias (incluidos los causados por fármacos o por el VIH).
- Niños y adolescentes (6 meses-18 años) tratados durante largos períodos con ácido acetilsalicílico (para evitar aparición de síndrome de Reye).
- Mujeres embarazadas que se encuentren en el segundo o tercer trimestre del embarazo durante la época gripal.
- Niños entre 6 y 23 meses de edad.
2. Población con riesgo de transmisión de la gripe a personas de alto riesgo:
- Personal sanitario en contacto con pacientes.
- Trabajadores en residencias geriátricas o cuidadores de pacientes con enfermedades crónicas.
- Trabajadores en residencias y centros de acogida de personas con riesgo elevado.
- Personal que presta asistencia domiciliaria a personas de riesgo elevado.
- Convivientes domiciliarios (incluidos los niños) con personas de alto riesgo.
- Convivientes con niños menores de 24 meses.
3. Personas que realizan servicios especiales a la comunidad o están en contacto directo con la población:
- Dependientes y cajeros en establecimientos públicos.
- Guías turísticos.
- Estudiantes.
Existen 2 tipos de vacunas. La vacuna inactivada, que contiene virus muertos, se administra por inyección intramuscular y puede usarse en todos los sujetos mayores de 6 meses de edad, incluida tanto la población sana como la portadora de enfermedades crónicas, y la vacuna atenuada, que contiene virus vivos capaces de replicarse, se administra por vía intranasal, es más cara y sólo ha sido aprobada su administración en la población sana de edades comprendidas entre los 5 y los 49 años, incluidas aquellas personas en contacto directo con población de alto riesgo. Esta vacuna atenuada no deberá indicarse en sujetos con antecedentes de síndrome de Guillain-Barré, así como en niños o adolescentes que reciban tratamiento crónico con ácido acetilsalicílico, embarazadas o con alergia a la proteína del huevo.
La preocupación por los posibles efectos secundarios ha limitado su utilización en algunos pacientes, aunque la vacuna inactivada no contiene virus vivos y, por tanto, no puede provocar infección gripal. Las reacciones locales son leves y suelen durar unas 24 h y, además, pueden aparecer a las 6-12 h de la vacunación fiebre, malestar y mialgias131. Han ocurrido raras reacciones alérgicas inmediatas en pacientes con hipersensibilidad al huevo. El efecto secundario más temido, síndrome de Guillain-Barré, sólo se ha asociado con la vacuna de 1976132.
Lucha contra el tabaquismo
El tabaquismo es el principal factor de riesgo de enfermedad invasiva por S. pneumoniae en personas jóvenes36. Además, aumenta el riesgo de NAC y la incidencia y gravedad de las neumonías debidas a varicela y Legionella37,133. El cese del hábito tabáquico disminuye a la mitad el riesgo de presentar NAC en los 5 años subsiguientes al abandono del consumo (nivel I).
Resumen de las recomendaciones
Epidemiología
La incidencia de la NAC en adultos en España es de 1,6-1,8 episodios/1.000 habitantes/año. Tiene predominio invernal y es más frecuente en ancianos varones (nivel II).
El porcentaje de enfermos con NAC que ingresan en el hospital es muy variable (22-61%). Aproximadamente el 9% de los pacientes ingresan en la UCI.
La mortalidad global de la NAC se ha cifrado en el 14%, oscilando entre el 37% de las ingresadas en UCI y el 2% de las tratadas de forma ambulatoria.
El diagnóstico etiológico de las NAC se alcanza hasta en el 40-60% de los casos.
La etiología más frecuente de las NAC tratadas de forma ambulatoria (grupo 1) es S. pneumoniae, seguida de M. pneumoniae (tabla I).
En el grupo de NAC hospitalizadas (grupo 2), el patógeno predominante es también S. pneumoniae, aunque también son frecuentes M. pneumoniae, H. influenzae, y bacilos gramnegativos y Legionella spp. (tabla I).
En las NAC que ingresan en la UCI (grupo 3), S. pneumoniae y Legionella spp. son causantes de la mayoría de los casos. Los bacilos gramnegativos son también frecuentes (nivel II) (tabla I).
El S. pneumoniae es el agente causante más importante de las NAC en mayores de 65 años en nuestro país, seguido a gran distancia por H. influenzae y L. pneumophila (nivel II).
En las NAC de los pacientes con EPOC los principales agentes aislados son S. pneumoniae, Chlamydophila pneumoniae y H. influenzae (nivel II). En EPOC graves con bronquiectasias asociadas se debe considerar P. aeruginosa (nivel II).
Los fumadores tienen un riesgo 4 veces superior de padecer una enfermedad neumocócica invasiva que los no fumadores.
Diagnóstico
El diagnóstico sindrómico de NAC se basa en la existencia de clínica de infección aguda acompañada de un infiltrado pulmonar de reciente aparición en la radiografía de tórax no atribuible a otra causa (nivel III).
En toda NAC que llegue al hospital se debe realizar hemograma, bioquímica elemental, y pulsioximetría o gasometría arterial, para evaluar su gravedad y posible ingreso (nivel III).
La radiología torácica en sus 2 proyecciones convencionales se debe plantear en los pacientes con NAC estudiados en centros hospitalarios, así como en los atendidos de forma ambulatoria que no experimentan mejoría clínica tras 48 h de tratamiento empírico (nivel III).
La afectación radiológica bilateral o de más de 2 lóbulos, y la existencia de derrame pleural indican gravedad (nivel III).
La curación radiológica suele ser posterior a la clínica, y en ocasiones se retrasa más de 8 semanas. Aunque no es necesario realizar una exploración radiológica previa al alta hospitalaria, es imprescindible confirmar radiológicamente la curación de la neumonía.
Diagnóstico etiológico (tabla IV)
En general, se debe emplear mayor número de técnicas de diagnóstico etiológico cuanto más graves sean las NAC, y pocas o ninguna en las NAC leves (nivel III). No debe retrasarse el inicio del tratamiento antimicrobiano para obtener una muestra adecuada para el diagnóstico etiológico.
En todas las NAC hospitalizadas se recomienda efectuar tinción de Gram y cultivo en esputo reciente (de menos de 30 min), sobre todo si se sospecha la presencia de un microorganismo resistente o poco habitual (nivel II).
En las NAC graves se recomienda la extracción de 2 hemocultivos seriados que, en caso de ser positivos, tendrán valor etiológico y pronóstico (nivel II).
Se considera razonable determinar la antigenuria neumocócica en las NAC que requieren ingreso hospitalario (nivel II).
Se recomienda determinar la antigenuria para Legionella en la s NAC hospitalizadas sin orientación diagnóstica inicial tras tinción de Gram de esputo y/o antigenuria neumocócica, en las NAC con criterios de gravedad o con fallo terapéutico previo a betalactámicos, así como en casos de NAC coincidentes con la sospecha de un brote comunitario epidémico de legionelosis.
No se recomiendan en la práctica clínica habitual el uso de serología ni de PCR en muestras no invasivas (nivel III).
El uso de técnicas invasivas para el diagnóstico etiológico sólo está indicado en las NAC de curso fulminante o que no responden al tratamiento antimicrobiano empírico inicial.
Escalas pronósticas y decisión de ingreso hospitalario
La escala de Fine es más útil para la detección de enfermos de NAC con bajo riesgo de mortalidad.
Recomendaciones para decidir el lugar donde el paciente va a ser tratado (domicilio u hospital):
1. Descartar condiciones de gravedad o que impidan el tratamiento domiciliario como la inestabilidad hemodinámica, enfermedades asociadas descompensadas, insuficiencia respiratoria, derrame pleural o la imposibilidad del tratamiento oral. Valorar las circunstancias o los problemas sociales, abuso de alcohol o drogas, o trastornos psiquiátricos que dificulten la adherencia al tratamiento (nivel II).
2. Calcular una escala pronóstica: si es un grado Fine I-II, enviar al paciente a domicilio; si es Fine III, valorar su ingreso para observación; si es Fine IV-V, se realiza el ingreso hospitalario. En el ámbito extrahospitalario utilizar el CRB-65 para valorar ingreso si ≥ 1 (nivel II).
Recomendaciones de ingreso en UCI:
1. Necesidad de ventilación mecánica o shock séptico (nivel III).
2. Presentar 2 criterios de los siguientes: presión sistólica < 90 mmHg, afectación multilobar y PaO2/FiO2 < 250 (nivel II).
3. Puntuación > 3 en el CURB-65 (nivel II).
Tratamiento
El tratamiento antimicrobiano de un paciente con NAC se establece de forma empírica, tras valorar la gravedad del cuadro, su etiología más probable y la prevalencia de los microorganismos más frecuentes en nuestra área.
En nuestro país se mantienen unos niveles de S. pneumoniae con sensibilidad disminuida a la penicilina entre 35 y 50%, y las resistencias de alto nivel han disminuido. La resistencia a macrólidos se sitúa en torno al 25-40%, sobre todo de alto nivel, afecta a todos los macrólidos y es insensible al incremento de dosis.
La antibioterapia ha de iniciarse tempranamente, antes de que transcurran 4 h desde el diagnóstico de NAC, lo que reduce la mortalidad y la estancia hospitalaria (nivel II).
Una vez instaurado el tratamiento antimicrobiano hay que hacer una revaluación clínica a las 24-48 h.
En los pacientes con NAC tratados de forma ambulatoria los antimicrobianos deben dirigirse fundamentalmente a tratar el neumococo (tablas VI y VII). Dentro de este grupo existe un subgrupo que tienen enfermedades crónicas asociadas u otros factores de riesgo de etiología no habitual, que requieren un tratamiento diferenciado (tablas VI y VII).
En los pacientes con NAC ingresados en el hospital se ha de tratar S. pneumoniae por ser el más frecuente, pero ha de tenerse presente el mayor riesgo de etiología de NAC por neumococo resistente o bacilos gramnegativos entéricos, así como de patógenos atípicos, incluida Legionella spp. (tablas VI y VII).
Las NAC que requieren ingreso en UCI se deben tratar con una cefalosporina de tercera generación a dosis altas, asociada a un macrólido o a una fluoroquinolona antineumocócica (tablas 6 y 7).
Las NAC con factores de riesgo para infección por P. aeruginosa se deben tratar con una terapia combinada frente a este patógeno, sin olvidar la cobertura frente a neumococo potencialmente resistente y Legionella spp.
La terapia secuencial es muy importante para intentar reducir la estancia media hospitalaria y el coste económico sin comprometer la seguridad de los pacientes. La duración mínima del antimicrobiano empírico parenteral debe ser de 2 a 4 días. El alta hospitalaria se podría dar a las 24 h de alcanzar la estabilidad clínica.
La duración total del tratamiento antibiótico es difícil de establecer. En general debe ser de 7 a 10 días en las NAC que no requieren ingreso, y de 10 a 14 días en las que ingresan en el hospital. Las NAC debidas a L. pneumophila, S. aureus o P. aeruginosa deben tratarse no menos de 14 días, y las que se presentan con cavitación pulmonar con sospecha de infección por anaerobios, pueden requerir tratamiento durante varias semanas (nivel II).
Las medidas generales ante una NAC incluyen una correcta hidratación, analgésicos, antitérmicos y medidas de soporte, como oxigenoterapia, ventilación mecánica en caso de insuficiencia respiratoria grave, y reposición de líquidos y/o aminas presoras para mantener la tensión arterial adecuada.
En caso de fracaso respiratorio agudo en pacientes con EPOC que sufren NAC grave, se debe intentar inicialmente la ventilación mecánica no invasiva (nivel I).
En caso de fracaso respiratorio en pacientes que no sufren EPOC con NAC grave, se puede iniciar la ventilación mecánica no invasiva, con estrecha atención a la evolución del paciente (nivel I).
Las causas de la evolución insatisfactoria de las NAC son variadas (tabla VIII).
La vacuna antigripal ha demostrado ser efectiva para prevenir o atenuar la enfermedad viral, tanto en ancianos como en jóvenes.
La vacuna antineumocócica 23-valente es efectiva para prevenir la enfermedad neumocócica invasiva: bacteriemia, meningitis o infección de cualquier lugar estéril. La vacuna antineumocócica heptavalente-conjugada protege contra los 7 serotipos que causan la mayoría de otitis media, neumonía y meningitis en niños.
El abandono del consumo de tabaco disminuye a la mitad el riesgo de sufrir NAC en los 5 años subsiguientes al cese del consumo (nivel I).
*I. Alfageme, J. Aspa, S. Belloa, J. Blanquerb, R. Blanquer, L. Borderías, C. Bravo, R. de Celis, X. de Gracia, J. Dorcac, J. Gallardo, M. Gallego, R. Menéndeza, L. Molinosa, C. Paredes, O. Rajas, J. Rello, F. Rodríguez de Castrob, J. Roig, F. Sánchez-Gascón, A. Torresc y R. Zalacaína
aCoordinador de Sección. bCoordinador global. cAsesor.
Correpondencia: Dr. J. Blanquer.
Unidad de Cuidados Intensivos Respiratorios.
Hospital Clínico Universitario.
Avda. Blasco Ibáñez, 17. 46010 Valencia. España.
Correo electrónico: blanquer–jos@gva.es