Las malformaciones pulmonares congénitas (MPC) conforman un grupo de entidades originadas por alteraciones en la embriogénesis del pulmón y de las vías respiratorias. Tanto el lugar (nivel del árbol traqueobronquial) como el momento (edad gestacional) del insulto embriológico se correlacionan con el tipo de lesión y la histopatología que se manifiesta1.
Se han establecido criterios clínicos, radiológicos e histopatológicos que permiten la clasificación de la mayor parte de las MPC. Las entidades que en la actualidad se consideran MPC son las malformaciones congénitas pulmonares de la vía aérea (congenital pulmonary airway malformations [CPAM]), secuestro pulmonar, quiste broncogénico, enfisema lobar congénito y atresia bronquial. Stocker2 clasifica la CPAM, anteriormente conocida como malformación congénita adenomatoidea quística, en 5 subtipos basándose en el número y tamaño de los quistes, así como en el origen anatómico de los mismos: Tipo 0: pulmón configurado por quistes pequeños de unos 0,5cm, no compatible con la vida; Tipo 1: quiste único o múltiples entre 2 a 10cm, que se originan a partir de bronquios o bronquiolos; Tipo 2: múltiples quistes de 0,5 a 2cm, de bronquiolos; Tipo 3: lesión sólida, con quistes menores de 0,5cm, de bronquiolo y conducto alveolar, y Tipo 4: quistes hasta 7cm, de origen acinar distal.
Se denomina secuestro pulmonar a un sector del pulmón no funcionante que recibe irrigación de la circulación sistémica y se clasifica en intralobar y extralobar, dependiendo de si posee pleura visceral común al pulmón o revestimiento pleural propio, respectivamente1.
Las malformaciones pulmonares congénitas son poco frecuentes, representan entre el 7,5 y 18,7% de todas las malformaciones de los diferentes órganos, variando ampliamente en su presentación clínica y gravedad, sobre todo en función del grado de afectación pulmonar. Pueden manifestarse a cualquier edad, fundamentalmente en niños y lactantes. En la evolución de algunas de ellas, sobre todo en la CPAM se ha descrito riesgo de infecciones respiratorias recurrentes o malignización3,4.
Por el comienzo clínico pueden diagnosticarse al nacer, casualmente en pruebas radiológicas con o sin clínica. La ecografía realizada en el periodo prenatal también permite el diagnóstico1,4,5.
El manejo de estas lesiones depende del tipo de malformación y de la aparición de síntomas, por ello se debe individualizar la conducta a seguir en cada caso y tipo de malformación; aunque la mayoría de los autores recomiendan la resección de la lesión no existe en la actualidad un consenso sobre la actitud quirúrgica, sobre todo en pacientes asintomáticos3,6,7.
El objetivo de esta revisión es describir los hallazgos de diagnóstico clínico, radiológicos, anatomopatológicos, así como la evolución y seguimiento de los 20 niños diagnosticados de MPC, evaluados en el Hospital Universitario Parc Tauli, entre los años 2006-2016.
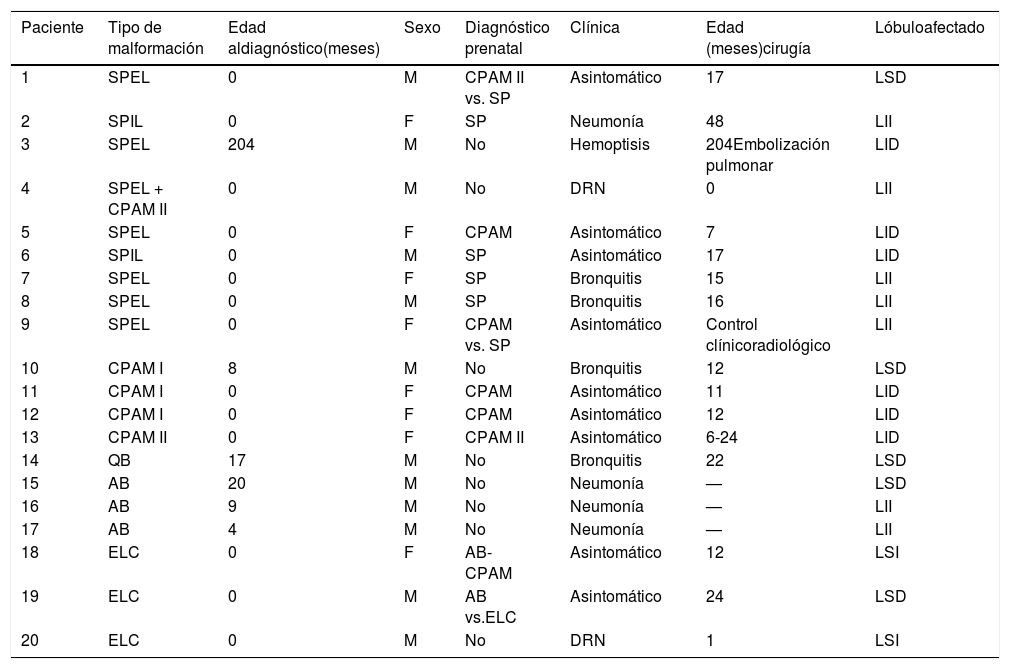
Se revisaron las historias clínicas de los niños con malformaciones pulmonares congénitas. Doce casos fueron niños (60%) y 8 (40%) niñas. El diagnóstico prenatal se realizó en 12 (60%) de los casos. Las malformaciones pulmonares congénitas encontradas fueron: secuestro pulmonar: 9 casos (45%): 7 extralobar (77,7%), 2 intralobar (22,22%); CPAM: 5 casos (25%): subtipo I: 3 (60%), subtipo II: 2 (40%), uno en asociación con secuestro extralobar; atresia bronquial: 3 (15%); quiste broncogénico: 1 (5%); enfisema lobar congénito 3 (15%). La presentación clínica en el periodo posnatal fue la siguiente: 2 pacientes presentaron distrés respiratorio neonatal. En el resto de malformaciones la presentación clínica fue la siguiente: 9 pacientes (45%) fueron asintomáticos, 3 (15%) presentaron infecciones pulmonares recurrentes y 6 (30%) episodios de bronquitis. En los 3 casos de atresia bronquial se practicó fibrobroncoscopia diagnóstica y la localización de la lesión se distribuyó de la siguiente forma: 5 en LSD, 7 en LII, 6 en LID y 2 en LSI. Se trataron con cirugía 16 (80%) con una edad media de 14 meses (2 días-48 meses) (tabla 1).
Características de los casos
| Paciente | Tipo de malformación | Edad aldiagnóstico(meses) | Sexo | Diagnóstico prenatal | Clínica | Edad (meses)cirugía | Lóbuloafectado |
|---|---|---|---|---|---|---|---|
| 1 | SPEL | 0 | M | CPAM II vs. SP | Asintomático | 17 | LSD |
| 2 | SPIL | 0 | F | SP | Neumonía | 48 | LII |
| 3 | SPEL | 204 | M | No | Hemoptisis | 204Embolización pulmonar | LID |
| 4 | SPEL + CPAM II | 0 | M | No | DRN | 0 | LII |
| 5 | SPEL | 0 | F | CPAM | Asintomático | 7 | LID |
| 6 | SPIL | 0 | M | SP | Asintomático | 17 | LID |
| 7 | SPEL | 0 | F | SP | Bronquitis | 15 | LII |
| 8 | SPEL | 0 | M | SP | Bronquitis | 16 | LII |
| 9 | SPEL | 0 | F | CPAM vs. SP | Asintomático | Control clínicoradiológico | LII |
| 10 | CPAM I | 8 | M | No | Bronquitis | 12 | LSD |
| 11 | CPAM I | 0 | F | CPAM | Asintomático | 11 | LID |
| 12 | CPAM I | 0 | F | CPAM | Asintomático | 12 | LID |
| 13 | CPAM II | 0 | F | CPAM II | Asintomático | 6-24 | LID |
| 14 | QB | 17 | M | No | Bronquitis | 22 | LSD |
| 15 | AB | 20 | M | No | Neumonía | — | LSD |
| 16 | AB | 9 | M | No | Neumonía | — | LII |
| 17 | AB | 4 | M | No | Neumonía | — | LII |
| 18 | ELC | 0 | F | AB-CPAM | Asintomático | 12 | LSI |
| 19 | ELC | 0 | M | AB vs.ELC | Asintomático | 24 | LSD |
| 20 | ELC | 0 | M | No | DRN | 1 | LSI |
AB: atresia bronquial; CPAM: malformación pulmonar congénita de la vía aérea; DRN: distrés respiratorio neonatal; ELC: enfisema lobar congénito; LID: lóbulo inferior derecho; LII: lóbulo inferior izquierdo; LSD: lóbulo superior derecho; LSI: lóbulo superior izquierdo; QB: quiste broncogénico; SP: secuestro pulmonar; SPEL: secuestro pulmonar extralobar; SPIL: secuestro pulmonar intralobar.
En el grupo de 9 pacientes asintomáticos (45%) 8 casos se trataron con cirugía, de los cuales 2 correspondieron a enfisema lobar congénito, 3 a CPAM y 3 a secuestro pulmonar. Un paciente con CPAM tipo II requirió 2 intervenciones quirúrgicas (6 y 24 meses de edad), con posterior seguimiento clínico-radiológico, en vista de la persistencia de CPAM. El paciente asintomático que no se trató con cirugía correspondió a un caso de secuestro pulmonar extralobar que se manejó de forma conservadora con evolución favorable.
En nuestra serie encontramos que la CPAM y el secuestro pulmonar fueron las malformaciones pulmonares más frecuentes. La ecografía prenatal proporcionó el diagnóstico en más de la mitad de los casos, la radiografía de tórax fue normal en el periodo neonatal en la mayoría de los pacientes diagnosticados por ecografía prenatal, siendo la TC de tórax la prueba que confirmó el diagnóstico en todos ellos. El 80% de los niños fueron tratados con cirugía, no evidenciándose complicaciones postoperatorias. En el resto de los pacientes la evolución fue favorable en 10 años de seguimiento.
Similar a lo encontrado en otras revisiones, el uso de la ecografía prenatal ha incrementado el diagnóstico de esta enfermedad, considerando la TC de tórax el patrón oro como método diagnóstico. Hasta el momento, según la literatura, existen todavía controversias en cuanto al manejo de los pacientes asintomáticos y muchos autores se inclinan por la cirugía electiva temprana para evitar el riesgo de complicaciones incluyendo las infecciones y el riesgo de malignización8,9. En la presente revisión, alrededor de la mitad de los pacientes estaban asintomáticos, siendo tratados con resección quirúrgica la mayoría de ellos.
Se han señalado criterios a favor de la cirugía en pacientes con más riesgo, mientras que pudiera optarse por un manejo conservador en los pacientes de menor riesgo3,10. Quienes proponen el tratamiento no quirúrgico refieren que algunas MPC pueden desaparecer en el periodo posnatal siendo la prevalencia de complicaciones desconocida6.
Existe en la actualidad una tendencia a realizar resecciones pulmonares mínimamente invasivas a través de videotoracoscopia, debido a que presenta baja morbilidad y proporciona buenos resultados postoperatorios11,12.
La participación de un equipo multidisciplinario es de vital importancia en el manejo de estos pacientes, debiendo determinar el tratamiento más adecuado de acuerdo al tipo de malformación y la presencia de síntomas, considerando el riesgo de complicaciones en cada caso y el beneficio de la cirugía.