La polisomnografía (PSG) nocturna es la técnica diagnóstica de referencia del síndrome de apneas-hipopneas durante el sueño (SAHS) en niños. El objetivo del estudio ha sido evaluar la utilidad diagnóstica de la poligrafía respiratoria (PR) en niños con sospecha clínica de SAHS remitidos a la Unidad de Trastornos Respiratorios del Sueño.
Pacientes y métodosSe estudió a 53 niños remitidos por sospecha clínica de SAHS (29 varones; 54,7%), con una edad media ± desviación estándar de 6,4±2,9 años. A todos ellos se les realizaron historia clínica, exploración física, PR (Edentec®) y PSG nocturna simultáneamente en el laboratorio de sueño. Se realizó el análisis estadístico para comparar ambas técnicas diagnósticas.
ResultadosDefiniendo el diagnóstico de SAHS como la presencia de un índice de apneas-hipopneas obstructivas (IAHO) igual o mayor de 3 en la PSG y un índice de eventos respiratorios (IER) de 3 o superior en la PR, la coincidencia diagnóstica fue del 84,9%. La diferencia de medias entre el IAHO y el IER no fue significativa (0,7±5,4; p=0,34). El coeficiente de correlación intraclase entre el IAHO y el IER fue de de 89,4 (intervalo de confianza del 95%, 82,4-93,7; p<0,001).
Para el diagnóstico de SAHS se consideraron los valores de IAHO iguales o mayores de 1; iguales o mayores de 3, e iguales o mayores de 5. Se calcularon las curvas de eficacia diagnóstica para cada uno de ellos y 4,6 resultó ser el mejor IER para los 3 valores de IAHO considerados. Al analizar por estratos de edad, en niños de 6 años o más el mejor IER obtenido para los 3 valores de IAHO considerados fue 2,1. En niños menores de 6 años se obtuvieron los siguientes valores de IER: 3,35 para IAHO de 1 o superior y 5,85 para IAHO de 3 o mayor y de 5 o superior.
ConclusionesLa PR realizada en el laboratorio de sueño es un método válido para el diagnóstico de SAHS en niños.
Overnight polysomnography (PSG) is the gold standard diagnostic tool for sleep apnea-hypopnea syndrome (SAHS) in children. The aim of the present study was to evaluate the usefulness of diagnostic respiratory polygraphy in children with clinically suspected SAHS referred to our sleep-disordered breathing clinic.
Patients and methodsWe studied 53 children referred with clinical suspicion of SAHS; 29 (54.7%) were boys and the mean (SD) age was 6.4 (2.9) years. After a medical history was taken and a physical examination performed, patients underwent respiratory polygraphy (Edentec) simultaneously with overnight PSG in the sleep laboratory. The 2 diagnostic tools were compared using statistical analysis.
ResultsSAHS was defined by an obstructive apnea-hypopnea index (OAHI) of 3 or more in overnight PSG and a respiratory disturbance index (RDI) of 3 or more in respiratory polygraphy. The rate of diagnostic agreement was 84.9%. The difference between the mean OAHI and RDI values was not significant (0.7 [5.4]; P=.34). The intraclass correlation coefficient between the OAHI and RDI was 89.4 (95% confidence interval, 82.4-93.7; P<.001).
When receiver operating characteristic curves were calculated for the OAHI cutoff points used for the diagnosis of SAHS (≥1, ≥3, and ≥5), the best RDI cutoff for all 3 OAHI values considered was found to be 4.6. When age strata were considered, in children 6 years or older the best RDI cutoff for the 3 OAHI values was 2.1. In children younger than 6 years the best RDI cutoff was 3.35 for OAHI ≥1 and 5.85 for OAHI ≥3 and ≥5.
ConclusionsRespiratory polygraphy in the sleep laboratory is a valid method for the diagnosis of SAHS in children.
El síndrome de apneas-hipopneas durante el sueño (SAHS) en los niños se define como un trastorno de la respiración durante el sueño que se caracteriza por obstrucción parcial de la vía aérea superior y/o obstrucción completa intermitente (apneas obstructivas), que interrumpe la ventilación y la arquitectura de sueño normal1,2. Se asocia con síntomas que incluyen ronquidos nocturnos habituales, dificultad de sueño y/o problemas de comportamiento. El SAHS infantil se asocia con importante morbilidad, ya que puede originar retraso del crecimiento y desarrollo, hipertensión pulmonar, alteraciones de la conducta y bajo rendimiento escolar3,4.
La técnica diagnóstica considerada de referencia hasta el momento es la polisomnografía (PSG) nocturna5-7, cuya realización e interpretación, sin embargo, no están adecuadamente estandarizadas2,8. En el adulto la poligrafía respiratoria (PR) está aceptada como método de diagnóstico del SAHS9, pero en los niños no está adecuadamente validada y hay pocos estudios al respecto10-13.
El objetivo principal del estudio ha sido evaluar la utilidad diagnóstica de la PR en niños con sospecha clínica de SAHS. Para ello se determinó el índice de eventos respiratorios (IER) en la PR realizada en el laboratorio de sueño y se comparó con el índice de apneas-hipopneas (IAH) determinado en la PSG nocturna y realizada de forma simultánea a aquélla.
Pacientes y métodosPoblación de estudioSe ha realizado un estudio de evaluación prospectivo, ciego y simultáneo, que incluyó a 55 niños, de los que 53 completaron el estudio. Todos habían sido remitidos por sospecha clínica de SAHS desde los Servicios de Otorrinolaringología y Pediatría a la Unidad de Trastornos Respiratorios del Sueño de Burgos desde julio de 2003 a septiembre de 2004. La muestra se compone de niños de ambos sexos de 2 a 14 años con signos y síntomas indicativos de SAHS (ronquido nocturno y/o pausas respiratorias nocturnas). Se excluyó a aquéllos con enfermedad concomitante grave, ya fuera médica o psiquiátrica, y a los que presentaban síntomas indicativos de enfermedades del sueño diferentes del SAHS. En todos los casos se obtuvo el consentimiento informado para la realización del estudio, que fue aprobado por el Comité Ético del Hospital General Yagüe.
MétodosA todos los pacientes incluidos en el estudio se les realizaron historia clínica y examen físico general, además de exploración otorrinolaringológica. Se recogieron la edad, el peso, la estatura y el sexo. La hipertrofia amigdalar se graduó del siguiente modo: grado I, ocupando el 0% del espacio entre los pilares; grado II, ocupando el 25% del espacio entre los pilares; grado III, ocupando el 50% del espacio entre los pilares, y grado IV, ocupando el 100% del espacio entre los pilares.
La PR y la PSG se efectuaron en el laboratorio de sueño de forma simultánea y vigilada entre las de 22.00 y 08.00h del día siguiente. Para la PSG nocturna se utilizó el polisomnógrafo Deltamed Coherence® 3NT versión 3.0 (Diagniscan, SA, ACH-Werfen Company, París, Francia), con registro de 2 canales de electroencefalograma (C3A2/O2A1), electrooculograma derecho e izquierdo, electromiograma tibial y submentoniano, electrocardiograma, flujo oronasal mediante termistor, movimientos torácicos y abdominales con bandas, posición corporal por sensor de posición, saturación de oxígeno mediante pulsioximetría, ronquido y flujo aéreo a través de cánula nasal. La PSG se corrigió de forma manual aplicando los criterios convencionales de Rechtschaffen y Kales14, y para la corrección de microdespertares (arousals) se emplearon los criterios de la American Academy of Sleep Medicine15. Los eventos respiratorios se corrigieron de forma manual siguiendo los criterios de la American Thoracic Society5,6.
Para la PR se utilizó el polígrafo Edentec Monitoring System, modelo 3711 (Edentrace II, Minnesota, EE.UU.), con registro de 6 canales: flujo oronasal mediante termistor, movimientos torácicos por pletismografía de impedancia, posición corporal con sensor de posición, ronquido mediante micrófono, frecuencia cardíaca y saturación de oxígeno por pulsioximetría. La PR fue corregida por el mismo investigador de forma manual y ciega con respecto al resultado obtenido en la PSG.
Se definió la apnea, tanto en la PSG como en la PR, como el cese del flujo oronasal de al menos 6s de duración (equivalente a 2 ciclos respiratorios), con mantenimiento del esfuerzo toracoabdominal (apnea obstructiva) o sin éste (apnea central). La hipopnea se definió como un descenso de al menos el 50% en la amplitud del flujo oronasal medido mediante termistor, durante al menos 6s, con mantenimiento del esfuerzo respiratorio, asociado a una caída de la saturación de oxígeno de al menos un 3% (en la PR) y/o a la presencia de un microdespertar (en la PSG)15,16.
En la PSG, el IAH se definió como el número de apneas e hipopneas por hora de sueño, incluidas las apneas centrales, y el IAH obstructivas (IAHO) como el número de apneas e hipopneas por hora de sueño, sin incluir las apneas centrales. En la PR, el IER se definió como el número total de eventos respiratorios (apneas más hipopneas), dividido por el tiempo total del estudio. El cese de flujo oronasal que frecuentemente sigue a los movimientos corporales y los artefactos secundarios a movimientos no se contabilizaron ni en la PSG ni en la PR.
Análisis estadísticoSe realizó un análisis descriptivo mediante distribuciones de frecuencias para las variables cualitativas, y media y desviación estándar para las variables cuantitativas. Se estimó la diferencia de medias con la prueba de la t de Student para muestras emparejadas. Se calculó asimismo el coeficiente de correlación intraclase (CCI), útil para medir la concordancia entre diferentes mediciones de una variable numérica, ya que mide la proporción de la variabilidad total que se debe a la variabilidad de los sujetos. Como toda proporción, los valores del CCI pueden oscilar entre 0 y 1, de modo que la máxima concordancia posible corresponde a un valor de CCI de 1. Se considera que la fuerza de la concordancia es buena cuando el CCI está comprendido entre 0,71 y 0,9.
También se empleó el gráfico de Bland-Altman17, procedimiento sencillo que sirve para evaluar la concordancia entre 2 sistemas de medida. Consiste en representar gráficamente las diferencias entre 2 mediciones frente a su media. En el caso de que no haya error sistemático, los puntos se distribuirán de forma aleatoria a uno y otro lado de la recta correspondiente a la diferencia 0 entre las medias.
Por otro lado, se realizaron curvas de eficacia diagnóstica, que proporcionan una representación global de la exactitud diagnóstica. El área bajo la curva de eficacia diagnóstica es el mejor indicador global de la precisión de una prueba diagnóstica: la exactitud máxima correspondería a un área bajo la curva de 1 y la mínima, a 0,5. Se efectuó un análisis de regresión logística, que sirve para valorar el papel de variables supuestamente relevantes en tanto que posibles modificadores de la probabilidad de tener o no tener cierta enfermedad cuando se dispone de una prueba de referencia y de una prueba diagnóstica alternativa.
Para los análisis de validez se consideraron los siguientes puntos de corte de IAH: ≥ 1; ≥ 3, y≥5. Se consideró significación estadística para valores de p<0,05 y los intervalos de confianza se calcularon para un nivel del 95%. El análisis se realizó con el paquete SPSS versión 12.0 (Chicago, Illinois, USA).
ResultadosDe los 55 niños estudiados, se excluyó a 2 del análisis, por fallo técnico y registro de PR de sólo 4h en el primer caso, y por abandono del laboratorio de sueño a las 03.00h en el segundo. Así pues, completaron el estudio 53 niños (29 varones; 54,7%) de entre 2 y 13 años, con una media±desviación estándar de edad de 6,4±2,9 años. En 4 niños (7,5%) el percentil del índice de masa corporal (IMC) era superior al 95, y 13 (24%) presentaban un percentil de IMC inferior al 50; el percentil medio era de 61,7±30,8 y el IMC medio de 18,2±2,7kg/m2. Todos los niños estudiados tenían antecedentes de procesos faringoamigdalares infecciosos y un 17% antecedentes familiares de SAHS.
El ronquido y la respiración bucal nocturna fueron las manifestaciones clínicas más frecuentes (92,5%). Otros síntomas encontrados fueron: congestión nasal nocturna (90,6%) y diurna (83%), pausas respiratorias nocturnas (73,6%), sueño inquieto (66%), sudoración nocturna (52,8%), cansancio diurno (39,6%), hiperactividad (30,2%), somnolencia (26,4%), enuresis (15,1%), agresividad (15,1%), dificultad para conciliar el sueño (13,2%) y déficit de atención (9,4%).
En la exploración otorrinolaringológica el hallazgo más frecuente fue la disminución del espacio faríngeo secundaria a hipertrofia amigdalar, que estaba presente en el 100%. En cuanto a la hipertrofia amigdalar, fue de grado I en el 1,9%; II en el 22,6%; III en el 43,4%, y IV en el 32,1%. Al analizar la relación entre el tamaño amigdalar y la presencia de SAHS (definido por IAHO≥3) no se observó relación entre el primero y la gravedad del segundo18.
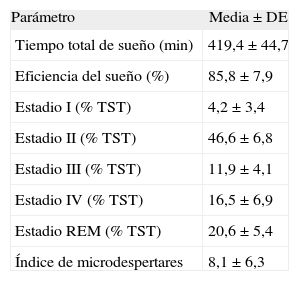
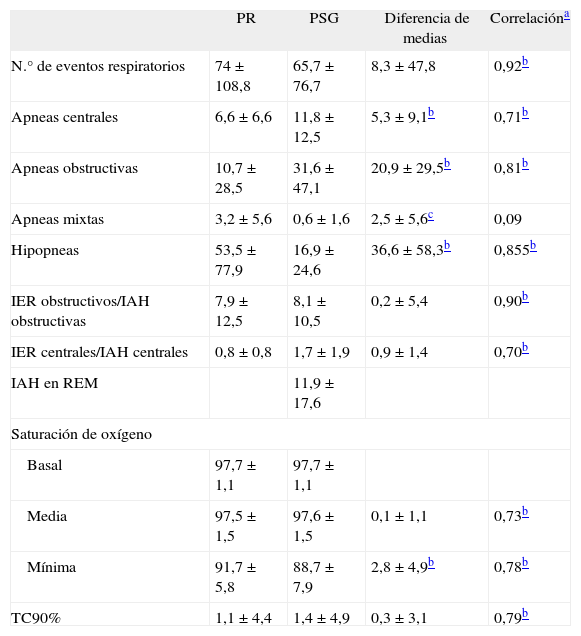
El tiempo total del estudio nocturno fue de 488,5±17,8min, y el tiempo total de sueño en la PSG, de 419,4±44,7min. Los valores medios de los parámetros neurofisiológicos se muestran en la tabla I. La prevalencia de SAHS según los puntos de corte de IAHO utilizados (≥ 1; ≥ 3, y≥5) fueron del 77,4, el 58,5 y el 50,9%, respectivamente. Al comparar los valores obtenidos en la PR y en la PSG (tabla II), las correlaciones obtenidas fueron significativas para todos los pares relacionados y no se observaron diferencias estadísticamente significativas en el número de eventos respiratorios (8,3±47,8; p>0,05). Definiendo como diagnóstico de SAHS la presencia de IAHO igual o mayor de 3 en la PSG e IER igual o superior a 3 en la PR, la coincidencia diagnóstica fue del 84,9%. La diferencia de medias entre IAHO e IER no fue significativa (0,7±5,4; p=0, 34). La concordancia entre ambos utilizando el CCI fue de 89,4 (intervalo de confianza del 95%, 82,4-93,7; p<0,001).
Parámetros neurofisiológicos en los niños estudiados (n=53)
| Parámetro | Media±DE |
| Tiempo total de sueño (min) | 419,4 ±44,7 |
| Eficiencia del sueño (%) | 85,8 ±7,9 |
| Estadio I (% TST) | 4,2 ±3,4 |
| Estadio II (% TST) | 46,6±6,8 |
| Estadio III (% TST) | 11,9 ±4,1 |
| Estadio IV (% TST) | 16,5 ±6,9 |
| Estadio REM (% TST) | 20,6±5,4 |
| Índice de microdespertares | 8,1 ±6,3 |
DE: desviación estándar; REM: movimientos oculares rápidos; TST: tiempo total de sueño.
Resultados medios±desviación estándar de la poligrafía respiratoria (PR) y polisomnografía (PSG) en los pacientes estudiados (n=53)
| PR | PSG | Diferencia de medias | Correlacióna | |
| N.° de eventos respiratorios | 74±108,8 | 65,7±76,7 | 8,3 ±47,8 | 0,92b |
| Apneas centrales | 6,6±6,6 | 11,8 ±12,5 | 5,3 ±9,1b | 0,71b |
| Apneas obstructivas | 10,7±28,5 | 31,6 ±47,1 | 20,9±29,5b | 0,81b |
| Apneas mixtas | 3,2±5,6 | 0,6 ±1,6 | 2,5±5,6c | 0,09 |
| Hipopneas | 53,5±77,9 | 16,9±24,6 | 36,6±58,3b | 0,855b |
| IER obstructivos/IAH obstructivas | 7,9±12,5 | 8,1±10,5 | 0,2±5,4 | 0,90b |
| IER centrales/IAH centrales | 0,8±0,8 | 1,7 ±1,9 | 0,9 ±1,4 | 0,70b |
| IAH en REM | 11,9 ±17,6 | |||
| Saturación de oxígeno | ||||
| Basal | 97,7±1,1 | 97,7 ±1,1 | ||
| Media | 97,5±1,5 | 97,6 ±1,5 | 0,1±1,1 | 0,73b |
| Mínima | 91,7±5,8 | 88,7 ±7,9 | 2,8±4,9b | 0,78b |
| TC90% | 1,1±4,4 | 1,4 ±4,9 | 0,3 ±3,1 | 0,79b |
IAH: índice de apneas-hipopneas por hora de sueño, en la PSG; IER: índice de eventos respiratorios (apneas e hipopneas), dividido por el tiempo total del estudio, en la PR; REM: movimientos oculares rápidos; TC90%: tiempo total del estudio con saturación de oxígeno por debajo del 90%.
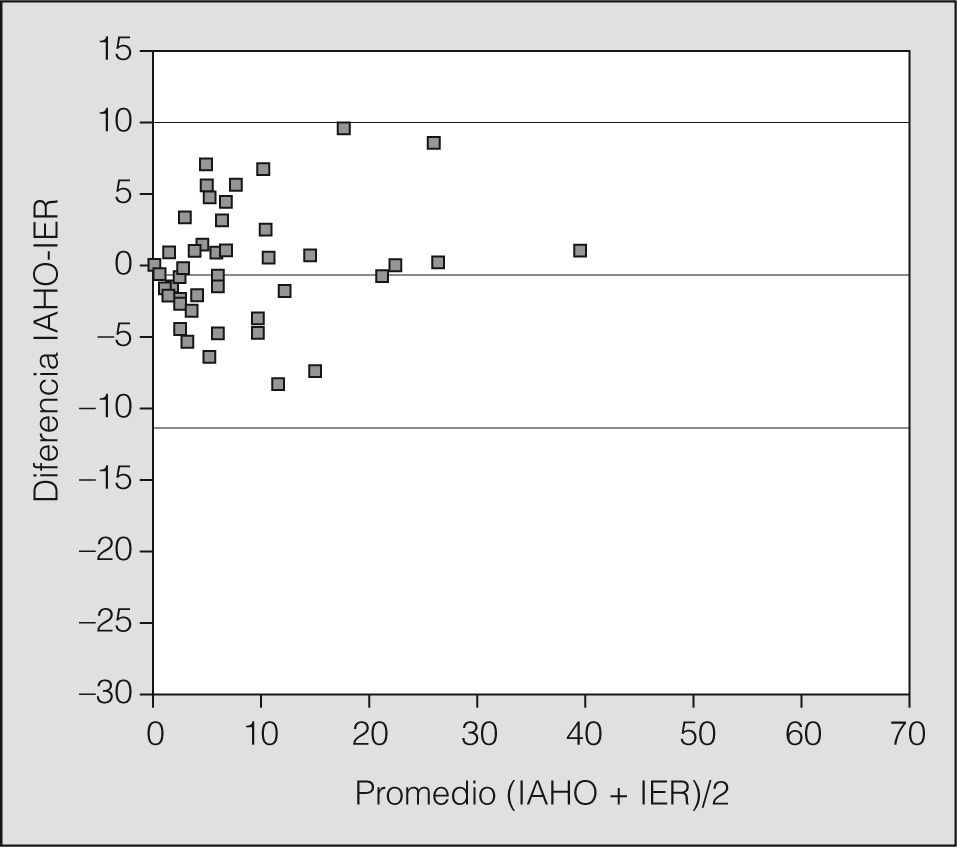
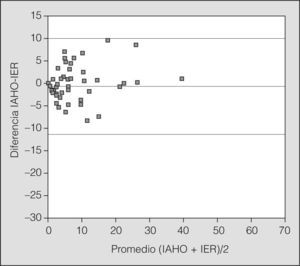
Para valorar el acuerdo entre ambas técnicas diagnósticas se utilizó el gráfico de Bland-Altman para el IAH y el IER (fig. 1), donde todos los valores, excepto uno, se situaron dentro del intervalo de confianza del 95%.
Gráfico de Bland-Altman, que muestra la concordancia entre la poligrafía respiratoria y la polisomnografía. Como se puede observar, los valores se sitúan dentro de los límites de concordancia. IAHO: índice de apneas-hipopneas obstructiva en la polisomnografía; IER: índice de eventos respiratorios, en la poligrafía.
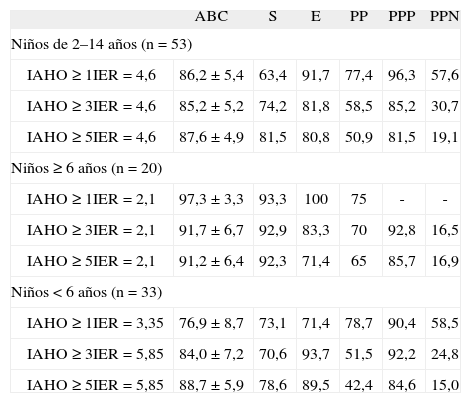
Para el diagnóstico de SAHS se consideraron los valores de IAHO≥1; ≥3, y≥5. Al calcular las curvas de eficacia diagnóstica para cada uno de ellos, el mejor IER fue 4,6 para los 3 valores de IAHO considerados, con un área bajo la curva de eficacia diagnóstica superior al 85% y una especificidad de hasta el 91,7% (tabla III).
Valores de utilidad diagnóstica del índice de eventos respiratorios (IER) para diferentes puntos de corte del índice de apneas-hipopneas obstructivas (IAHO)
| ABC | S | E | PP | PPP | PPN | |
| Niños de 2–14 años (n=53) | ||||||
| IAHO≥1IER=4,6 | 86,2 ±5,4 | 63,4 | 91,7 | 77,4 | 96,3 | 57,6 |
| IAHO≥3IER=4,6 | 85,2 ±5,2 | 74,2 | 81,8 | 58,5 | 85,2 | 30,7 |
| IAHO≥5IER=4,6 | 87,6 ±4,9 | 81,5 | 80,8 | 50,9 | 81,5 | 19,1 |
| Niños≥6 años (n=20) | ||||||
| IAHO≥1IER=2,1 | 97,3 ±3,3 | 93,3 | 100 | 75 | - | - |
| IAHO≥3IER=2,1 | 91,7 ±6,7 | 92,9 | 83,3 | 70 | 92,8 | 16,5 |
| IAHO≥5IER=2,1 | 91,2 ±6,4 | 92,3 | 71,4 | 65 | 85,7 | 16,9 |
| Niños<6 años (n=33) | ||||||
| IAHO≥1IER=3,35 | 76,9±8,7 | 73,1 | 71,4 | 78,7 | 90,4 | 58,5 |
| IAHO≥3IER=5,85 | 84,0±7,2 | 70,6 | 93,7 | 51,5 | 92,2 | 24,8 |
| IAHO≥5IER=5,85 | 88,7±5,9 | 78,6 | 89,5 | 42,4 | 84,6 | 15,0 |
ABC: área bajo la curva de eficacia diagnóstica; E: especificidad; PP: probabilidad pretest o prevalencia; PPN: probabilidad postest negativa; PPP: probabilidad postest positiva; S: sensibilidad.
Al analizar por estratos de edad, en niños de 6 años o más el mejor IER obtenido para los 3 valores de IAHO considerados fue de 2,1, con un área bajo la curva de eficacia diagnóstica mayor del 90% y una especificidad del 100% (tabla III). En niños menores de 6 años se obtuvieron los siguientes valores de IER: 3,35 para IAHO≥1 y 5,85 para IAHO≥3 y≥5 (tabla III)
Análisis de regresión logísticaSe realizó un análisis de regresión logística para los 3 valores de IAHO utilizados (≥ 1; ≥ 3, y≥5) con las siguientes covariables: percentil del IMC extremo (< 5 o>95), ronquido, pausas respiratorias, somnolencia, hiperactividad e IER dicotomizado (< 4,6 o≥4,6). Estas covariables se seleccionaron del total de variables recogidas a partir de la creación previa de tablas de contingencia de cada una de las variables con respecto a un IAHO≥1, ≥ 3 y≥5. El modelo global era significativo en todos los casos, pero la única variable estadísticamente significativa en todos los casos y con todos los modelos empleados fue el IER dicotomizado. Los modelos de regresión no mejoraron las sensibilidades y especificidades obtenidas en la curva de eficacia diagnóstica.
DiscusiónEl SAHS en los niños es una enfermedad frecuente, cuya prevalencia se estima en un 5%19. Aunque los niños con trastornos respiratorios del sueño son mayores consumidores de servicios de salud, es una enfermedad infradiagnosticada20. Además, se asocia con importante morbilidad3,21 y, por tanto, su diagnóstico precoz tiene implicaciones relevantes desde el punto de vista de la prevención de la salud. Encontrar alternativas diagnósticas eficientes a la PSG puede mejorar la accesibilidad al diagnóstico y tratamiento de los niños con SAHS. Según los datos existentes, el punto de corte de normalidad elegido con mayor frecuencia es un índice de apneas obstructivas de 1. Sin embargo, no se conoce cuál es el valor clínicamente significativo y no hay unanimidad por lo que se refiere al diagnóstico del SAHS infantil5,16. Recientemente se han publicado los valores polisomnográficos de normalidad en niños7,22,23.
Diversos estudios han intentado buscar alternativas diagnósticas a la PSG, tales como la utilización de cuestionarios basados en el espectro de manifestaciones clínicas, grabaciones audiovisuales, pulsioximetría noctur na o PSG de siesta diurna24-27. No obstante, ya que del resultado de los estudios practicados se va a derivar una actuación quirúrgica como tratamiento de elección (adenoamigdalectomía), y dada la gran variabilidad de resultados obtenidos con bajas sensibilidades, hay que ser cauteloso y contemplar la PSG como la técnica diagnóstica de referencia en la práctica clínica diaria5,6. El Grupo Español de Sueño28 define el SAHS en niños con un IAHO entre 1 y 328, y la Internacional Classification of Sleep Disorders considera por consenso el diagnóstico de SAHS en niños cuando hay uno o más eventos respiratorios por hora de sueño29.
Pocos estudios han abordado el papel de la PR en el diagnóstico del SAHS infantil y todos ellos se realizaron con un escaso número de pacientes, en poblaciones seleccionadas y sin comparar simultáneamente con la PSG10-13. El estudio que presentamos es el primero en la literatura médica revisada que aborda de forma sistemática la utilidad diagnóstica de la PR, y su fiabilidad radica en la realización simultánea de PSG y PR. Nuestros datos demuestran una elevada coincidencia diagnóstica (84,9%) y una alta correlación (89,4%) en el diagnóstico de SAHS para un IAHO igual o mayor de 3 en la PSG y un IER igual o superior a 3 en la PR. Como muestra el gráfico de Bland-Altman, todos los valores (diferencias entre IAH e IER), excepto uno, se sitúan dentro del intervalo de confianza del 95% y, por otro lado, la distribución de los valores es aleatoria en torno a la diferencia cero; es decir, la PR no sobrestima ni infraestima con respecto a la PSG. El análisis de concordancia mediante las curvas de eficacia diagnóstica muestra una buena validez de la PR con respecto a la PSG.
Dado que no hay acuerdo en cuál es el valor de IAH clínicamente significativo, en el presente estudio se han utilizado los 3 valores de IAHO más empleados en la literatura médica y, al calcular las curvas de eficacia diagnóstica para cada uno de ellos (≥ 1; ≥ 3, y≥5), se ha identificado que un valor de IER≥4,6 es el punto con mayor especificidad y, por tanto, con menor número de falsos positivos. Incluso en niños menores de 6 años los valores de especificidad obtenidos en nuestro estudio muestran un alto perfil de seguridad para excluir falsos positivos.
Es necesario tener en cuenta que en los niños con SAHS la estructura del sueño está conservada, como también se observa en nuestro estudio (tabla I), y por lo tanto una técnica como la PR puede aportar, al menos teóricamente, soluciones diagnósticas, si bien el problema fundamental reside en la selección de los parámetros a medir.
En el presente estudio, a pesar de que se utilizó cánula de presión nasal en la PSG, para el análisis y comparación de los resultados obtenidos en ambas técnicas diagnósticas se empleó el termistor. Al igual que otros autores30, observamos que, aunque la cánula tiende a identificar de forma más precisa que el termistor los eventos respiratorios tipo hipopneas, presenta mayor pérdida de señal que éste, y la falta de registro de flujo bucal en un niño es una importante limitación que podría solventarse con el uso de cánulas buconasales en los registros poligráficos.
En este estudio no se ha identificado un modelo clínico predictivo de SAHS en los niños, debido a la alta probabilidad pretest de la población estudiada.
Nuestro estudio presenta las siguientes limitaciones: a) se realizó en población seleccionada y con alta probabilidad de SAHS, si bien el objetivo es la validación de un sistema sencillo para establecer el diagnóstico adecuado de SAHS en niños con sospecha clínica; b) en la PSG no se utilizó la medida de anhídrido carbónico, al ser una variable que no se registra de forma habitual en la PR, y c) la PR se realizó en el laboratorio de sueño, si bien la mayor potencialidad práctica de esta prueba reside en su utilización en el domicilio, aunque creemos que antes de ello es necesario llevar a cabo estudios en los que se comparen la PR y la PSG efectuadas de forma simultánea.
No obstante, en un centro con experiencia en el diagnóstico y tratamiento de los trastornos respiratorios del sueño el empleo de la PR en niños es fiable para establecer la presencia de SAHS, así como para la toma de decisiones terapéuticas, lo que resulta particularmente importante cuando no es posible el acceso a la PSG.
El debate sobre el papel de la PR y la PSG en niños no debe contemplarse como una situación dicotómica donde sólo una técnica esté indicada, sino que ambas son técnicas diagnósticas que deben emplearse para mejorar la atención de los pacientes, teniendo en cuenta que una valoración inadecuada de un niño puede conducir a no prescribir un tratamiento adecuado o a decidir una cirugía innecesaria. La aplicación de pruebas simplificadas para el diagnóstico del SAHS no sólo en adultos, sino también en niños, debe realizarse dentro de un adecuado sistema de coordinación en el que se incluya la presencia de la PR en el algoritmo de diagnóstico y, en caso de duda diagnóstica, realizar PSG.