Introducción
La disfunción del músculo esquelético (DME) es frecuente en pacientes con enfermedad pulmonar obstructiva crónica (EPOC), en particular aquéllos con bajo peso corporal1. Este hecho es clínicamente relevante, ya que limita su capacidad de ejercicio y empeora tanto el pronóstico como la calidad de vida1-3. Los mecanismos celulares que subyacen en el desarrollo de la DME en la EPOC son poco conocidos4,5. Para poder desarrollar nuevos tratamientos dirigidos a paliar la DME en pacientes con EPOC es esencial mejorar este conocimiento.
El ciclo de contracción/relajación del músculo esquelético está regulado por la concentración citoplásmica de calcio (Ca2+). La familia de proteínas denominada adenosintrifosfatasa dependiente de Ca2+ del retículo sarcoplásmico (SERCA) constituye un elemento regulador clave de la concentración citoplásmica de Ca2+. Al secuestrar Ca2+ en el interior del retículo sarcoplásmico, SERCA induce y mantiene la relajación muscular6,7. Hay al menos 3 genes que codifican esta familia de proteínas: a) SERCA1, que se expresa en fibras esqueléticas de contracción rápida; b) 2 variantes de ARN mensajero que se expresan en fibras de contracción lenta, en el músculo cardíaco o en la musculatura lisa (SERCA2a), y también en una variedad de tejidos no musculares (SERCA2b), y finalmente c) SERCA3, que también se expresa en una gran variedad de tejidos7.
No se ha investigado el papel potencial de las alteraciones en la expresión y/o función de SERCA en el músculo esquelético de los pacientes con EPOC. En el presente estudio se ha determinado la expresión de SERCA2 mediante inmunotransferencia (Western blot) en 2 grupos de pacientes con EPOC (con peso normal y con peso bajo). Las biopsias obtenidas de estos pacientes se habían utilizado en un trabajo anterior donde se determinó la concentración de la óxido nítrico sintetasa inducible (iNOS)8. Precisamente en este contexto se ha investigado la posibilidad de que SERCA2 esté nitrosinada en el músculo esquelético de estos pacientes. Ello se fundamenta en que nuestro grupo8 y otros autores9 han demostrado la presencia de estrés nitrosativo en el músculo esquelético de pacientes con EPOC y bajo peso corporal, y en que tanto el estrés oxidativo como el nitrosativo alteran la actividad de SERCA10-13.
Pacientes y métodos
Pacientes
El diagnóstico de EPOC se realizó de acuerdo con los criterios establecidos internacionalmente por la European Respiratory Society y la American Thoracic Society (ERS/ATS)14. Los pacientes pertenecían a nuestra consulta externa y presentaban obstrucción al flujo aéreo intensa o muy intensa según la clasificación ERS/ATS14. Todos ellos tenían hábitos sedentarios. Se les estudió en situación clínica estable, que se definió por la ausencia de un cambio de tratamiento y/o exacerbación durante los 3 meses previos al estudio. Todos ellos recibieron tratamiento broncodilatador, combinado con esteroides inhalados en 9 casos. Ninguno recibió esteroides orales. Para evitar factores de confusión sobre el músculo, sólo se estudió a varones y se excluyó a los pacientes que presentaban otras enfermedades inflamatorias crónicas, enfermedades neuromusculares, insuficiencia cardíaca, insuficiencia renal, hepatopatía, diabetes mellitus y alcoholismo. Los pacientes se distribuyeron en 2 grupos según su índice de masa corporal (IMC) fuera mayor o menor15 de 21 kg/m². Todos firmaron un consentimiento informado y la comisión de ética del hospital aprobó el estudio.
Función pulmonar
La espirometría forzada (GS, Warren E. Collins, Braintree, MA, EE.UU.) se midió en todos los participantes del estudio de acuerdo con las recomendaciones internacionales16; los valores de referencia fueron los de la población mediterránea17. Las presiones arteriales de gases en sangre (IL BG3, Izasa, Barcelona, España) se determinaron en sangre arterial.
Biopsias musculares
Las biopsias percutáneas de aguja se obtuvieron de la porción lateral del cuádriceps femoral bajo anestesia local, tal como se ha descrito previamente18. Las biopsias musculares se congelaron inmediatamente y se guardaron a -80 °C hasta su análisis. Las biopsias obtenidas de estos pacientes se habían utilizado en un trabajo anterior donde se determinó la concentración de la iNOS8.
Inmunodetección de SERCA2 y α-tubulina
Las técnicas de inmunotransferencia (Western blot) se llevaron a cabo, tal como se ha descrito con anterioridad, en nuestro laboratorio8,15. Brevemente, las muestras musculares congeladas (5-10 mg) se homogeneizaron (1:10 w/v) en un tampón con 10 mM de Tris y pH de 7,5 frío, que contenía un 1% de SDS y una mezcla de inhibidores de proteasas (Roche Diagnostics, Mannheim, Alemania). Las muestras se centrifugaron a 12.000 g durante 10 min a 4 °C. Se mezclaron 100 µl del sobrenadante resultante con un volumen igual de tampón de carga (125 mM de Tris, pH de 6,8, un 4% de SDS, un 20% de glicerol, un 10% de 2-mercaptoetanol y un 0,005% de azul de bromofenol). La mezcla se hirvió durante 4 min y se guardó a 80 °C para análisis posteriores. La concentración de proteínas se determinó mediante el método de Bradford19. Entre 20 y 50 µl de la suspensión resultante se cargaron en un gel al 10% de poliacrilamida y se procedió a su electroforesis (SDS-PAGE). Las proteínas separadas se transfirieron a membranas de nitrocelulosa (Western blot) y se incubaron en PBS que contenía un 4% de leche en polvo desnatada (solución bloqueante) durante 1 h a temperatura ambiente con agitación suave. Las membranas se incubaron durante toda la noche a 4 °C en solución bloqueante que contenía el anticuerpo primario y, después de su lavado con PBS, se incubaron durante 2 h a temperatura ambiente con los anticuerpos secundarios. Se usaron los siguientes anticuerpos: anti-SERCA2 a una dilución de 1:1000 (Santa Cruz Biotechnology, Inc, Santa Cruz, CA, EE.UU.) y anti-*-tubulina (Sigma Chemical CO, St. Louis, MO, EE.UU.) a una dilución de 1:2000. Los anticuerpos secundarios utilizados fueron un anticuerpo antiinmunoglobulina G de conejo ligado a peroxidasa de rábano para SERCA2 y un anticuerpo antiinmunoglobulina G de ratón ligado a peroxidasa de rábano para la *-tubulina (Amersham International, Buckinghamshire, Reino Unido). La inmunorreactividad se detectó mediante un sistema quimioluminiscente de detección de Western blot (Pierce, Rockford, Illinois, EE.UU.). Para ello, se agregaron 2 ml del reactivo de detección (SuperSignal West Dura Extended Duration Substrate, Pierce) a la membrana de nitrocelulosa y se dejó actuar durante 30 s. Seguidamente las bandas resultantes se detectaron mediante el sistema de detección de quimioluminiscencia GeneGenius (Syngene, Cambridge, Reino Unido). La intensidad de las bandas se determinó por análisis densitométrico usando el programa GeneTools (Syngene). Los resultados se normalizaron siempre por el contenido de *-tubulina.
Inmunoprecipitación de SERCA2 mediante anticuerpos antinitrotirosina
Los 2 conjuntos de sobrenadantes congelados obtenidos tal como se ha descrito (IMC menor o mayor de 21 kg/m2) se unificaron y se centrifugaron a 12.000 g durante 2 min a 4 °C. Se añadió a ambos sobrenadantes un anticuerpo monoclonal de ratón antinitrotirosina (HyCult Biotech, Uden, Países Bajos) a una dilución de 1:1000 y se incubó durante 2 h a 4 °C. Seguidamente, se añadieron 50 µl de proteína-A-agarosa recombinante (Sigma) a la suspensión y se incubó durante 1 h a 4 °C. Las muestras se centrifugaron después durante 30 s a 12.000 g. Los sedimentos resultantes se lavaron 3 veces en 1 ml de TBS a 4 °C durante 20 min y se volvieron a suspender en 100 µl. Esta suspensión se mezcló con el mismo volumen de tampón de carga (125 mM de Tris, pH de 6,8, un 4% de SDS, un 20% de glicerol, un 10% de 2-mercaptoetanol y un 0,005% de azul de bromofenol) y se hirvió durante 4 min. La concentración de proteínas se determinó mediante el método de Bradford19. Se cargaron 50 µl de la suspensión anterior en un gel del 10% de poliacrilamida y se procedió a su electroforesis (SDS-PAGE) procesándose y detectándose tal como se ha descrito anteriormente.
Análisis estadístico
Los resultados se presentan como la media ± desviación estándar. Se utilizó el test de Mann-Whitney para establecer la significación estadística de las diferencias observadas entre los grupos estudiados. Las correlaciones entre las variables de interés se exploraron mediante el test de correlación de Spearman. Se consideró significativo un valor de p < 0,05.
Resultados
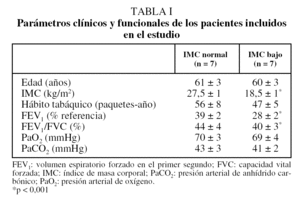
En la tabla I se recogen las características clínicas y funcionales de los pacientes estudiados. La edad fue similar en ambos grupos. El hábito tabáquico no fue diferente entre los pacientes con IMC bajo o normal. Ambos grupos mostraron obstrucción grave de las vías aéreas (particularmente los pacientes con IMC bajo) e hipoxemia arterial moderada sin hipercapnia.
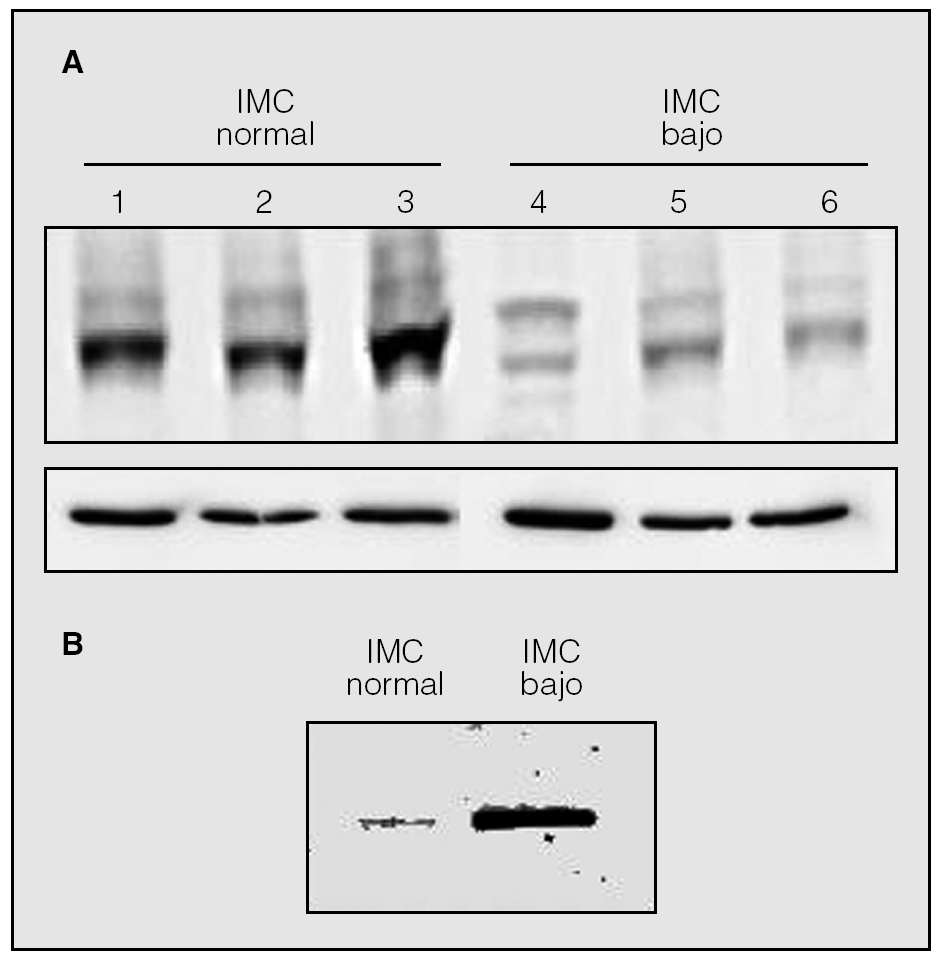
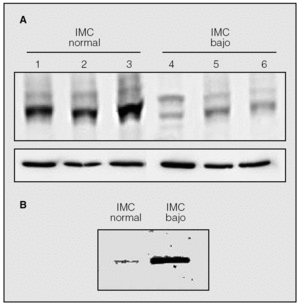
En la figura 1 (panel A) se muestra un experimento de inmunotransferencia representativo de la expresión de SERCA2 en biopsias del cuádriceps femoral de 3 pacientes con EPOC e IMC normal (carriles 1-3) y 3 pacientes con EPOC e IMC bajo (carriles 4-6). Se observa que la expresión de SERCA2 está claramente reducida en estos últimos. En promedio, los valores de SERCA2 (normalizados por el contenido de *-tubulina) eran significativamente inferiores en los pacientes con IMC bajo (4,2 ± 0,5 frente a 8,1 ± 1,2 IOD [densidad óptica integrada]; p < 0,05).
Fig. 1. Panel A: inmunotransferencia representativa de SERCA2 en el cuádriceps femoral de 3 pacientes con EPOC e índice de masa corporal (IMC) normal (carriles 1-3) y 3 pacientes con EPOC e IMC bajo (carriles 4-6). Panel B: inmunotransferencia de SERCA2 una vez inmunoprecipitada a partir de extractos de cuádriceps femoral obtenidos de pacientes con IMC bajo (n = 7) o normal (n = 7).
Los experimentos de inmunoprecipitación de los sobrenadantes de cuádriceps femoral con anticuerpo antinitrotirosina seguidos de detección de SERCA2 mediante inmunotransferencia demostraron que SERCA2 estaba nitrosinada en los pacientes con EPOC e IMC bajo, comparados con los que presentaban un IMC normal (fig. 1, panel B).
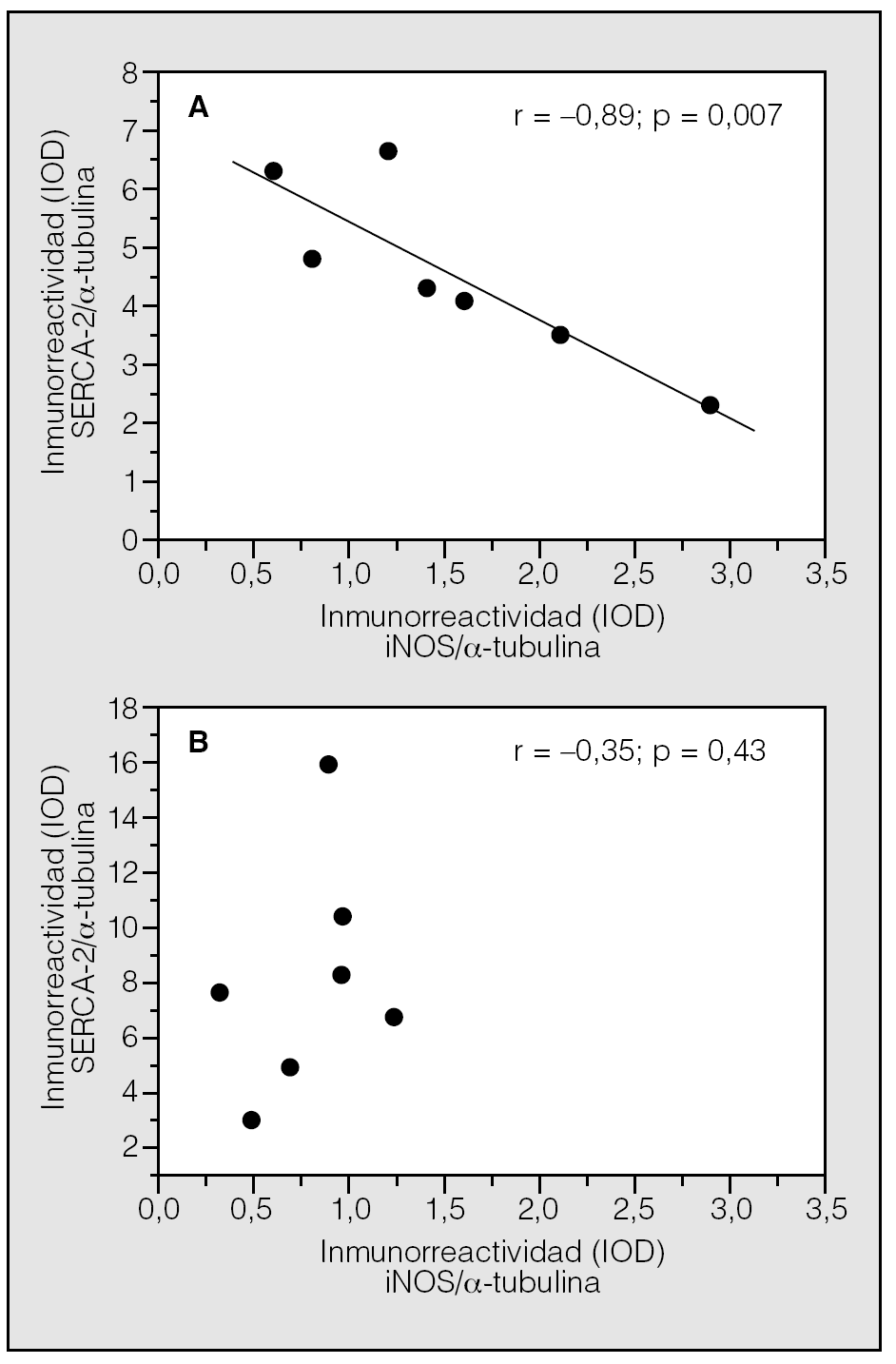
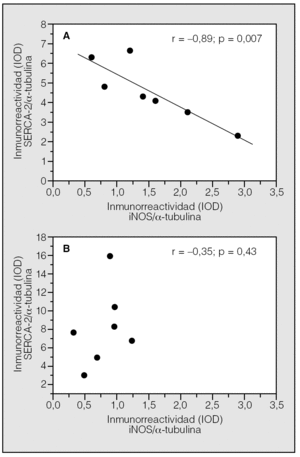
En un trabajo anterior habíamos demostrado la sobreexpresión de la iNOS en el cuádriceps femoral de pacientes con EPOC y bajo peso corporal8. En la figura 2 se observa la existencia de una relación negativa y significativa entre los valores de SERCA2 y las concentraciones de iNOS en pacientes con EPOC y bajo peso corporal (r = -0,89; p = 0,007), relación que no existe en pacientes con EPOC e IMC normal (r = 0,35; p = 0,43).
Fig. 2. Relación entre las concentraciones de SERCA2 y la expresión de la isoforma inducible de la óxido nítrico sintetasa (iNOS) en el músculo esquelético de pacientes con EPOC e índice de masa corporal bajo (panel A) y normal (panel B). IOD: densidad óptica integrada.
Discusión
SERCA2 es una proteína clave en la regulación de la concentración citosólica del Ca2+ y, por tanto, de la función muscular6,7. La pérdida de la expresión de SERCA2 se ha descrito previamente en otras situaciones clínicas también caracterizadas por DME, como necrosis20, insuficiencia cardíaca21 y denervación muscular22. Sin embargo, hasta la fecha no se habían descrito alteraciones en la expresión de SERCA2 en la EPOC. En consonancia con estas observaciones previas, nuestros resultados muestran que la expresión de SERCA2 está disminuida en los pacientes con EPOC y bajo peso corporal (fig. 1, panel A).
Varios mecanismos celulares pueden explicar la pérdida de la expresión de SERCA2 en el músculo esquelético de pacientes con EPOC y bajo peso corporal. Por una parte, podría deberse a un aumento de la tasa de proteólisis y degradación. En apoyo de esta hipótesis, nuestros resultados muestran que SERCA2 está nitrosinada en los pacientes con IMC bajo (fig. 1, panel B), un cambio estructural que facilita su degradación a través de la vía de la ubicuitina-proteasoma10-13. En relación con lo anterior, nuestro grupo8 y otros9 han demostrado previamente la presencia de estrés nitrosativo y sobreexpresión de la iNOS en el cuádriceps femoral de pacientes con EPOC y bajo peso corporal. En la figura 2 se observa la existencia de una correlación negativa y significativa entre las concentraciones de SERCA2 y las de iNOS en los pacientes con EPOC y bajo peso corporal (r = -0,89; p = 0,007), relación que no se aprecia en los pacientes con EPOC e IMC normal (r = 0,35; p = 0,43). Este análisis comparativo ha podido realizarse porque las muestras utilizadas en este estudio son las mismas que empleó nuestro grupo para estudiar la expresión de la iNOS8 en el músculo esquelético de pacientes con EPOC. Estas observaciones son indicativas de una relación causal entre la inducción de iNOS y la pérdida de SERCA2 por nitrosinación y degradación en el músculo esquelético de los pacientes con EPOC y bajo peso corporal.
En nuestro estudio no podemos excluir que procesos de remodelación de fibras musculares, como disminución del diámetro, contribuyan a explicar la disminución de SERCA2. En este contexto hay que señalar que precisamente en vastus lateralis de pacientes con EPOC y pérdida de masa muscular se ha documentado una atrofia específica en las fibras de contracción rápida IIA/IIX y IIX23. Dado que SERCA2 se expresa en fibras de contracción lenta7, no parece que la disminución de su concentración sea debida a este proceso atrófico de las fibras musculares. Ello apunta a que la disminución de SERCA2 está relacionada con su nitrosinación y activación de procesos proteolíticos. En futuros estudios intentaremos determinar la presencia de ubicuitinización en SERCA2 nitrosinada y la activación del proteasoma.
Estudios realizados en humanos han dado como resultado la ausencia de modulación de la expresión de SERCA2 en el músculo esquelético tras ejercicio continuado24. Por lo anterior, y por la naturaleza sedentaria de los pacientes con EPOC, es razonable considerar que la actividad física no desempeña un papel importante en la disminución de SERCA2 en nuestro estudio. Independientemente de la causa o causas por las que la concentración de SERCA2 es baja en pacientes con EPOC y bajo peso corporal, esta baja concentración de SERCA2 podría contribuir a la patogenia de la DME de estos pacientes a través de varias vías. Estudios in vitro han demostrado que la nitrotirosinación de SERCA origina su inactivación12. Por tanto, es probable que en pacientes con EPOC que pierden peso la SERCA2 no sólo esté disminuida (fig. 1, panel A), sino que también esté inactivada por nitrotirosinación (fig. 1, panel B). En un contexto especulativo, ambas anormalidades pueden alterar la homeostasis del calcio iónico y contribuir hipotéticamente a la DME al menos de 2 maneras diferentes: pueden alterar de forma negativa los ciclos de contracción y relajación del músculo6,7, y por otra parte, el exceso de Ca2+ puede fijar calcineurina25 y alterar la expresión de varios factores de transcripción dependientes de calcio, MEF2 (Drosophila melanogaster MADS domain transcription factor 2) y MyoD (Drosophila melanogaster myogenic-determination protein)26,27, que son claves para el mantenimiento y la regeneración del músculo esquelético.
En resumen, estos resultados muestran por primera vez que los pacientes con EPOC y bajo peso corporal presentan menor expresión de SERCA2 en el músculo esquelético, que ésta se encuentra nitrosinada y que existe una correlación negativa entre las concentraciones de SERCA2 y las de iNOS en pacientes con IMC bajo. El papel que pueden desempeñar estas alteraciones celulares en la pérdida de masa muscular y/o en la DME de estos pacientes deberá evaluarse en futuros estudios.
Estudio financiado en parte por ABEMAR, FIS (PI 020978), Red Respira (RTIC C03/11) y SEPAR.
Correspondencia:
Dr. X. Busquets.
Unidad de Investigación. Hospital Universitario Son Dureta (Edificio D, primera planta).
Andrea Doria, 55. 07014 Palma de Mallorca. Baleares. España.
Correo electrónico: busquets@hsd.es
Recibido: 7-10-2005; aceptado para su publicación: 20-3-2006.