Introducción
Se entiende por asma bronquial la alteración respiratoria causada por un obstrucción de los bronquios y que se acompaña de una inflamación crónica de las vías respiratorias inferiores. La obstrucción se debe en parte a la hiperreactividad bronquial, es decir, a la tendencia a una contracción excesiva de la musculatura lisa de los bronquios frente a diversos estímulos. La disminución del calibre de los bronquios dificulta el paso de aire hacia los pulmones y consecuentemente genera en el paciente una crisis de disnea. A la obstrucción bronquial contribuyen la inflamación crónica, la hipersecreción de moco y el fenómeno de reestructuración tisular o remodeling que altera la microestructura de las vías respiratorias afectadas. El cuadro descrito es en gran medida el resultado de alteraciones inmunológicas y bioquímicas en ciertos individuos con una predisposición genética.
Los factores etiológicos del asma pueden ser diversos. El ejercicio, los antiinflamatorios no esteroideos, las infecciones virales y los alérgenos se encuentran entre los más frecuentes. Cuando la causa del asma es un alérgeno se habla de asma alérgica, atópica o extrínseca. Si bien el asma de origen alérgico y el asma de origen no alérgico comparten mecanismos patogénicos, es probable que los alérgenos generen un patrón de respuesta inmunológica particular especialmente en el inicio del proceso. Por eso, y porque se trata del tipo de asma más prevalente, este artículo se centra en el asma alérgica.
Se estima que el asma afectará a 300 millones de personas en todo el mundo en 2010 teniendo en cuenta la incidencia actual (150 millones de personas afectadas) y la progresión anual1,2. En el 80% de los niños y adolescentes afectados, el asma es de origen alérgico y en España un 40% de los casos de asma en adultos jóvenes (20-44 años) tiene un componente alérgico según los datos preliminares del subestudio de la encuesta de Salud Respiratoria-Comisión Europea3,4. Este incremento de la prevalencia del asma alérgica especialmente en los países más desarrollados se atribuye, entre otras causas, y de acuerdo con la teoría más en boga, conocida como "hipótesis de la higiene", a mejoras sanitarias como la menor incidencia de infecciones virales y de infestaciones parasitarias y la incorporación de nuevas vacunas a los programas5. El detonante de la hipótesis de la higiene fue la observación de que dichas mejoras se acompañan de un aumento de la incidencia de enfermedades atópicas, atribuible posiblemente a cambios en los mecanismos inmunológicos6. El asma es una enfermedad de difícil control farmacológico que supone, además de una lacra sanitaria, un problema económico de primera magnitud por absentismo laboral, gasto farmacéutico y disminución de la productividad7. La dificultad en su control estriba en que el tratamiento actual no resuelve la enfermedad y se encamina fundamentalmente a contrarrestar los episodios de broncospasmo y controlar la inflamación subyacente en el proceso crónico, una fase de la enfermedad de particular dificultad terapéutica. A las limitaciones del tratamiento se añade el riesgo de fallecimiento del paciente por ataques agudos, estimado en 18 por 1.000.000 de habitantes2. La falta de un tratamiento farmacológico más eficaz del asma alérgica se debe en gran medida al desconocimiento de las alteraciones inmunológicas o bioquímicas precisas que la originan. La investigación básica y clínica en pacientes asmáticos resulta fundamental para el avance del conocimiento de la patogenia del asma, pero hay obstáculos científicos y éticos que impiden desenmascarar determinados aspectos de la enfermedad. La aparición en la última década de modelos de asma alérgica inducida en el ratón, ha impulsado la investigación en este terreno y ofrece sin duda un valor añadido a los estudios en pacientes asmáticos, a los estudios in vivo en otros modelos animales y a los experimentos in vitro y ex vivo.
En este artículo se describen las similitudes patogénicas entre el asma alérgica del humano y la de los modelos inducidos en el ratón, se destaca la particular utilidad del asma en los múridos y se recogen algunos de los datos bibliográficos que la refrendan.
Investigación del asma alérgica in vivo
Investigación en pacientes asmáticos
Se han desarrollado diversas técnicas experimentales para evaluar el impacto de las alteraciones celulares y moleculares en el curso del asma en pacientes. La toma de muestras de tejidos de pacientes asmáticos en diferentes fases de la enfermedad y su posterior análisis es una de ellas. Se recogen por broncoscopia biopsias de la mucosa bronquial para evaluar el patrón de respuesta celular local y la expresión de mediadores y su posible repercusión en la actividad broncopulmonar8,9. Se determinan también en sangre las fluctuaciones moleculares y celulares sistémicas, y se estudian los posibles polimorfismos genéticos que se asocian al asma alérgica10. Por otro lado, con la finalidad de recoger muestras de la mucosa bronquial directamente expuesta al alérgeno, y por lo tanto de unificar las características del tejido en estudio, se han desarrollado técnicas de exposición local (challenge) de la mucosa bronquial de voluntarios asmáticos a los alérgenos frente a los cuales se les sabe hipersensibles11 y se han realizado estudios ex vivo con muestras de pacientes12. Análisis similares se pueden realizar mediante un lavado broncoalveolar (BAL), para determinar y cuantificar las células y mediadores presentes11. Tanto la biopsia bronquial como el BAL son técnicas que no están exentas de riesgos para los pacientes, por lo que su uso comporta reparos éticos cuando se aplican exclusivamente con un fin experimental.
Con las debidas restricciones éticas, estos procedimientos experimentales han sido muy útiles para entender algunos aspectos de la patogenia del asma alérgica, pero deben destacarse los siguientes motivos por los cuales se requiere de modelos alternativos para la investigación in vivo de la enfermedad: a) la dificultad de tomar muestras de determinados órganos (p. ej., parénquima pulmonar o bronquiolos) de pacientes asmáticos; b) la dificultad de realizar diversos análisis paralelos en un mismo paciente y de recoger muestras de tejidos del sistema respiratorio durante un período de tiempo (estudios temporales); c) los problemas para llevar a cabo simultáneamente estudios celulares/moleculares y estudios funcionales del sistema respiratorio en el humano; d) la limitación en el tamaño de la muestra poblacional cuando se trata de pacientes; e) la heterogeneidad de las poblaciones problema (asmáticos) y control (no asmáticos) que se evalúan, y f) la imposibilidad legal de realizar ensayos con fármacos en pacientes en la fase previa a los ensayos clínicos.
Por todo ello se ha experimentado con numerosas especies a las cuales se les ha inducido asma mediante una gran variedad de protocolos, con el objetivo de que nos permitan llegar allí donde no llegan los estudios en pacientes asmáticos.
Modelos animales de asma alérgica
Las principales características funcionales y patogénicas del asma alérgica se han observado en diversos modelos animales. Las especies utilizadas han sido el ratón13, la rata14, la cobaya15, el conejo16, el hurón17, el perro18, el gato19, la oveja20, el cerdo21, algunos primates22 e incluso el caballo23. Algunas de estas especies desarrollan asma alérgica de forma espontánea y a otras se les induce experimentalmente. De entre estas últimas, además del ratón, los modelos experimentales utilizados con mayor frecuencia han sido la cobaya, la oveja y el mono. El modelo de cobaya sensibilizada a la ovoalbúmina (OVA) se caracteriza, al igual que el asma humana, por una fase aguda temprana y una fase crónica más tardía tras el contacto con el alérgeno, por la existencia de una inflamación pulmonar eosinofílica y por hiperreactividad bronquial15,24. Este modelo fue el más utilizado hasta que se describieron los primeros modelos en el ratón, y ha servido especialmente para evaluar el interés terapéutico de diversas moléculas15, pero no ofrece la versatilidad genética del ratón, y tampoco se dispone de tantos reactivos específicos de especie que permitan identificar gran parte de las fluctuaciones moleculares y celulares en el estudio de su patogenia25. El modelo de asma en la oveja también se caracteriza por una fase aguda temprana seguida de una fase crónica más tardía, acompañadas de hiperreactividad bronquial26. Además, desde el punto de vista anatómico y funcional, los pulmones ovinos normales se asemejan mucho a los humanos20,27,28. Aunque la inducción de asma en la oveja se ha realizado en su mayor parte con alérgenos de nematodos, sobre todo Ascaris suum29-31, recientemente se ha publicado un modelo de oveja sensibilizada a ácaros del polvo, un alérgeno que causa comúnmente asma en pacientes, y se ha visto que, además de las alteraciones mencionadas, la oveja desarrolla una respuesta específica de inmunoglobulina (Ig) E con una intensa eosinofilia20. Por último, cabe comentar brevemente que el modelo de primate se emplea desde hace más de 25 años. Al principio se estudiaban animales espontáneamente sensibilizados a A. suum32, pero en la actualidad existe ya un modelo inducido en el que se sensibilizan los animales a ácaros del polvo y que reproduce prácticamente todas las características clínicas y patogénicas del asma humana22. A pesar de su interés científico, el coste que supone trabajar con ovejas y primates, la duración de los experimentos, las dificultades en su manejo, la falta de reactivos desarrollados para valorar la expresión molecular y la mayor reprobación de su utilización en el laboratorio que otras especies los convierten en modelos menos utilizados por ser poco explotables científicamente.
Por motivos fundamentalmente científicos, pero también económicos y de facilidad de uso (estabulación, manejo, disponibilidad de reactivos específicos de especie), el animal universalmente utilizado como modelo de asma alérgica hoy día es el ratón, del que, con respecto a otras especies, cabe además destacar la posibilidad de su manipulación genética (transgénicos y knockouts) e inmunológica (ratones con inmunodeficiencias espontáneas o inducidas).
Modelos de asma alérgica en el ratón
Se han propuesto muchos modelos experimentales de asma inducida en el ratón. En general, todos los protocolos de inducción se basan en una sensibilización sistémica mediante la inyección de un alérgeno con el fin de generar una respuesta inmunitaria de memoria, seguida de la reexposición local del sistema respiratorio al mismo alérgeno. En ocasiones, en la sensibilización se administra el alérgeno junto con un coadyuvante o compuesto inmunopotenciador inespecífico como el sulfato de aluminio o alum para garantizar una respuesta inmunitaria suficientemente intensa. A continuación se describen de forma breve algunos de los factores a tener en cuenta a la hora de diseñar un protocolo de inducción de asma alérgica en el ratón.
Cepa de ratón. Estudios comparativos han demostrado que no todas las cepas de ratón responden de igual manera al contacto con un alérgeno. Se han observado diferencias entre unas y otras, probablemente sustentadas en diferencias genéticas, en el grado de hiperreactividad bronquial, en la producción de IgE e incluso en el tipo de respuesta inmunitaria celular. En lo que concierne a las cepas más comúnmente utilizadas, se ha visto, por ejemplo, que los ratones BALBc sensibilizados desarrollan una mayor hiperreactividad bronquial33,34, generan 4 veces más IgE total e IgE específica34 y contienen más células y una mayor concentración de citocinas en el BAL33,34 que los ratones C57BL/6 sensibilizados. Los investigadores se decantan, por lo general, por las cepas más propensas a expresar un fenotipo atópico y por eso la BALBc se cuenta entre las más utilizadas. Estudios recientes, sin embargo, proponen que para la evaluación de las modificaciones estructurales en los bronquios se utilice un modelo crónico en la cepa A/J por la mayor semejanza con los cambios observados en pacientes35.
Alérgeno. De entre los numerosos antígenos utilizados en la inducción de asma en ratones, el más común ha sido la OVA, si bien actualmente se tiende a emplear aeroalérgenos causantes del asma espontánea en personas, como ácaros del polvo (Dermatophagoides pteronyssimus y D. farinae)13 y pólenes, sobre todo el de la ambrosía (ragweed)36, una planta común en el norte de Europa y en Norteamérica (en España predominan el polen de las gramíneas, de la parietaria y el olivo como causa de alergia, pero en nuestro conocimiento no se han establecido modelos con éstos). Los aeroalérgenos naturales ofrecen la ventaja de que son compuestos suspendidos en el aire que de forma natural alcanzan el organismo a través de las vías respiratorias, al contrario que la OVA, que en todo caso accedería espontáneamente al organismo sobre todo por vía digestiva para desencadenar alergias de origen alimentario. La identificación y producción mediante técnicas biotecnológicas de los alérgenos permiten, en vez de administrar extractos de éstos, exponer a los ratones a moléculas muy puras. Éste es el caso del ácaro del polvo, del cual se sabe que al menos 2 componentes (Der p 1 y Der p 5) son en parte responsables de la activación de la respuesta inmunitaria y de la subsiguiente inducción de asma37. Recientemente se ha estudiado un nuevo enfoque de inducción, que es el de sensibilizar a los ratones con 2 antígenos recombinantes, uno de ácaros del polvo (Der f 1) y otro de cucarachas (Bla g 2), y se ha visto que esta combinación produce más inflamación pulmonar y daño epitelial que cada uno de ellos por separado38. Con respecto a la dosis de alérgeno que debe utilizarse, el rango de concentraciones administradas es muy amplio y varía según la fase del protocolo de inducción y el alérgeno. Para la sensibilización sistémica se han utilizado desde 1 hasta 800 µg de antígeno, aunque en un estudio en el que se comparan diferentes dosis de OVA se vio que 10 µg eran suficientes para inducir asma en el ratón39. En la fase de challenge o activación, como normalmente se utilizan aerosoles, las soluciones de OVA suelen ser de entre el 1 y el 5%. En cambio, utilizando directamente uno de los principales alérgenos de los ácaros del polvo (Der p 1) es suficiente 1 µg para sensibilizar a los ratones40. En cualquier caso, las concentraciones de alérge no a las que se someten los animales son por lo general elevadas, aspecto que se corrige paulatinamente con la introducción de los modelos crónicos.
Vía de administración o de exposición al alérgeno. En la mayoría de los modelos descritos la sensibilización del animal se realiza por vía intraperitoneal, mientras que en la reexposición al antígeno (activación o challenge) suele utilizarse la vía intranasal por inyección directa en las fosas nasales o bien por nebulización41,42. Los protocolos más recientes y más depurados proponen que ambas fases se realicen por vía aerógena con el fin de imitar el proceso natural de exposición en los pacientes asmáticos13,36.
Duración de la inducción de asma en ratones. La inducción de asma alérgica en los ratones requiere entre días y meses dependiendo del protocolo. Se ha trabajado principalmente con los modelos de corta duración (o exposición corta al alérgeno), en los que en un período relativamente breve (entre días y pocas semanas) se expone a los animales a elevadas concentraciones de alérgeno, lo que da lugar al llamado "modelo de asma aguda". Los modelos de exposición corta o agudos no reproducen algunos de los signos del asma alérgica observados en los asmáticos crónicos. Esta carencia impulsó el desarrollo de los modelos de exposición larga o crónicos. En el intento de inducir modelos de asma crónica mediante OVA, se observó que la nebulización del alérgeno durante largos períodos, sin sensibilización sistémica previa, conducía a tolerancia inmunológica; es decir, el sistema inmunitario dejaba de responder al contacto con la OVA tras sucesivas exposiciones43,44. Este fenómeno de tolerancia en modelos murinos de asma sugeriría que la respuesta inmunitaria de la mucosa respiratoria es autolimitante, y éste podría ser uno de los mecanismos utilizados por el sistema inmunitario para prevenir el avance de la inflamación alérgica en el pulmón; por lo tanto, en los pacientes con asma crónica habría habido previamente un defecto en la regulación de este proceso45. En otros experimentos se observó que la administración prolongada de OVA a animales sensibilizados no conseguía mantener las "características asmáticas" y acababa con un descenso bien de la inflamación pulmonar46, bien de la hiperreactividad bronquial42,47. Además, se han empezado a desarrollar modelos de exposición continua a dosis bajas de aeroalérgenos, es decir, modelos en los que no se distingue una fase de sensibilización de una fase de activación o challenge. Se destaca el modelo crónico de asma alérgica a extractos de ácaros del polvo, recientemente descrito por Johnson et al13, cuyos resultados son muy esperanzadores porque se han logrado mimetizar características del asma crónica que no se observan en los modelos agudos, como la reestructuración sostenida de los tejidos (o remodeling) subsiguiente a la inflamación. Esta semejanza pudiera deberse a que, además, el protocolo de inducción recoge muchas similitudes con la exposición natural a los alérgenos.
En función de lo que se quiera estudiar convendrá más el uso de un modelo de asma alérgica de exposición corta o larga al alérgeno. Así, los modelos de asma aguda ofrecen ventajas prácticas para el estudio de mecanismos del proceso inflamatorio y el broncospasmo, mientras que lo s modelos crónicos permiten estudiar cambios estructurales a largo plazo y su influencia en la obstrucción bronquial.
Caracterización clínica y fisiopatológica del asma alérgica en el ratón
Los modelos de asma alérgica inducida en el ratón generalmente se caracterizan por la existencia de hiper-reactividad bronquial, inflamación broncopulmonar, aumento de la concentración sérica de IgE e hipersecreción mucosa. Además, los modelos crónicos presentan cambios estructurales de las vías respiratorias. A continuación se repasan estas características y las similitudes entre la enfermedad en ambas especies.
Hiperreactividad bronquial y broncospasmo
El broncospasmo es el síntoma principal del asma en pacientes y es la manifestación clínica de las alteraciones inmunológicas celulares y moleculares subyacentes responsables de la hiperreactividad bronquial. Igualmente la mayoría de los modelos de asma alérgica en ratón presentan hiperreactividad bronquial. Uno de los motivos que impulsaron el desarrollo de los modelos de asma en el ratón fue precisamente la posibilidad de medir la respuesta bronquial en estos animales. La evaluación de la función respiratoria en los ratones asmáticos se puede llevar a cabo por los diferentes métodos que a continuación se describen brevemente.
Técnicas ex vivo para la evaluación de la reactividad bronquial. Mediante el método del baño de órganos, se aísla la tráquea de animales sensibilizados, se introduce en el baño y se estimula su musculatura lisa con campos eléctricos o bien por la adición al baño de compuestos broncoconstrictores como la histamina o la metacolina48. Por este procedimiento se puede medir de forma aislada, sin las interferencias que producen la oxigenación arterial o los elementos cardiovasculares, por ejemplo, la reactividad muscular de las principales vías respiratorias, que se cree en gran medida responsable de la disfunción pulmonar en el asma humana49. Esta técnica no permite sin embargo reproducir el impacto en la obstrucción bronquial del edema de la mucosa bronquial, del moco y del estrechamiento de las vías respiratorias, lo cual hace en muchas ocasiones que sea preferible la utilización de modelos in vivo.
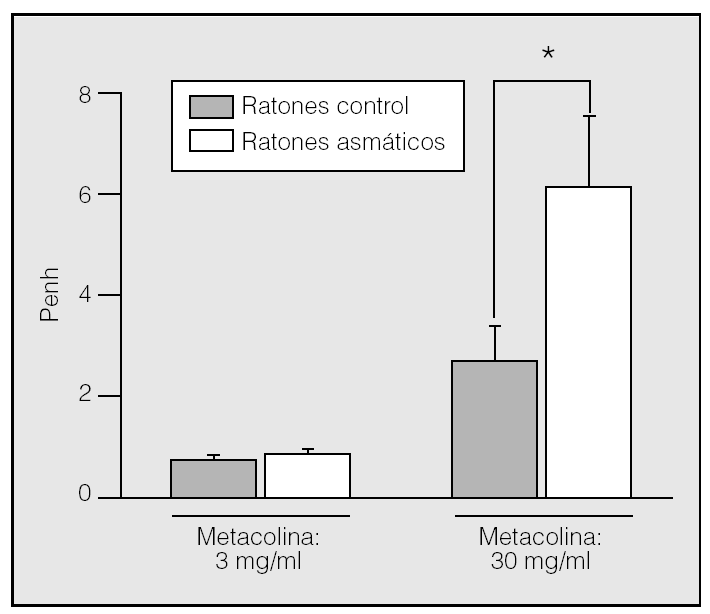
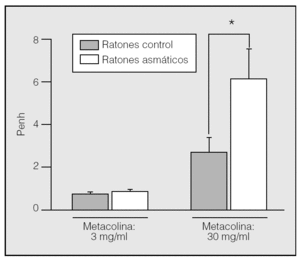
Técnicas in vivo para la evaluación de la reactividad bronquial. Para recoger en un mismo modelo la mayor parte de los fenómenos que pueden conducir a la obstrucción bronquial, es preferible trabajar con modelos in vivo. Se pueden utilizar ratones anestesiados o ratones conscientes dada la disponibilidad actual de métodos invasivos y no invasivos para evaluar el broncospamo. El método invasivo más utilizado consiste en intubar al animal con una cánula intratraqueal para medir directamente, mediante un pletismógrafo, la resistencia broncopulmonar al paso del aire50,51. Esta técnica es útil pero compleja, porque requiere de la difícil canulación de la vena de la cola (caudal) o bien de la vena subclavia, entraña los inconvenientes de que no se puede administrar el antígeno durante la determinación de la presión respiratoria, la metacolina se administra por vía intravenosa y además el animal se sacrifica tras finalizar la medición, con lo que resulta imposible la revaluación de la función respiratoria en un mismo animal. En el método no invasivo, por el contrario, el animal consciente se introduce en una cámara y se mide la función respiratoria mediante la variable denominada Penh (fig. 1) con un pletismógrafo de cuerpo entero (WBP, de whole body plethysmograph). El hecho de que no sea necesario anestesiar al animal y la ausencia de trastornos o daño físico permiten realizar varias mediciones en un mismo ratón en diferentes fases. Aunque algunos autores recomiendan la confirmación del Penh con parámetros que reflejen directamente la obstrucción respiratoria mediante métodos invasivos52, Hamelmann et al41 demostraron la correlación entre la medición de la hiperreactividad bronquial a la metacolina mediante WBP y la resistencia pulmonar y la presión intrapleural valoradas por otros procedimientos. Parte de las dudas que suscitó el WBP estriba en que la reactividad bronquial medida por este método carece de unidades, puesto que deriva de un procesamiento matemático de señales respiratorias empíricas53-55. Sin embargo, la demostración de que el Penh obtenido con el WBP refleja la hiperreactividad, y a pesar de la elevada inversión inicial, ha provocado que el número de grupos de investigación que adoptan el WBP como método de elección para evaluar la función broncopulmonar en ratones asmáticos haya aumentado. Lo atestigua el número creciente de publicaciones de primer orden en las que se cita este procedimiento56-60. Nuestra experiencia con el WBP nos permite afirmar que se trata de un método sencillo, rápido y reproducible para comparar la hiperreactividad bronquial de ratones sensibilizados con la de ratones normales en respuesta al broncoconstrictor metacolina. Esta medición suele hacerse 24 h después de la última exposición del animal al alérgeno, pero con el WBP puede también realizarse en otros estadios del proceso para seguir su evolución. Por ejemplo, puede evaluarse la función broncopulmonar antes y después de la inducción de asma, o bien en las fases aguda y crónica del proceso, o antes y después de un tratamiento. En la figura 2 se muestran los componentes fundamentales de nuestro equipo WBP (Buxco Europe, Ltd.) y se resume su funcionamiento.
Fig. 1. Reactividad bronquial en ratones con asma inducida mediante extracto de ácaros del polvo y en ratones control (no asmáticos), medida mediante el pletismógrafo de Buxco Europe, Ltd., en animales conscientes tras la exposición por vía aerógena a 2 concentraciones del broncoconstrictor metacolina. Se observa cómo a la concentración baja de metacolina (3 mg/ml) la reactividad bronquial de los ratones asmáticos y control es la misma, pero a la concentración más elevada (30 mg/ml) los ratones asmáticos presentan hiperreactividad bronquial. *p < 0,05.
Fig. 2. Equipo para la medición de la función respiratoria en ratones conscientes no inmovilizados (Buxco Europe, Ltd.). Se indican las 4 partes fundamentales del equipo: a) nebulizador, que reparte la metacolina (o el broncoconstrictor elegido) aerosolizada a cada cámara al flujo constante preseleccionado; b) pletismógrafo de cuerpo entero, con 4 cámaras con ratones en el interior, cada una de las cuales tiene un transductor acoplado que transforma la señal respiratoria en señal eléctrica y la envía al amplificador; c) regulador de flujo de aire, que mantiene un flujo de aire libre de fármaco y constante en el interior de las cámaras pletismográficas, y d) amplificador que recibe las señales captadas por el transductor de cada cámara, las amplifica y las traduce en datos para ser visualizados y analizados por el software Biosystem XA de Buxco.
Histopatología broncopulmonar en ratones asmáticos
Uno de los aspectos determinantes para establecer un paralelismo entre el asma en pacientes y el asma en múridos es la caracterización histopatológica de las vías respiratorias y del parénquima pulmonar. En el asma humana destacan una inflamación crónica broncopulmonar, con abundancia de eosinófilos localizados incluso intraepitelialmente y presencia también de otras células inflamatorias, y cambios estructurales característicos de la pared de las vías respiratorias que secundan al proceso inflamatorio (remodeling).
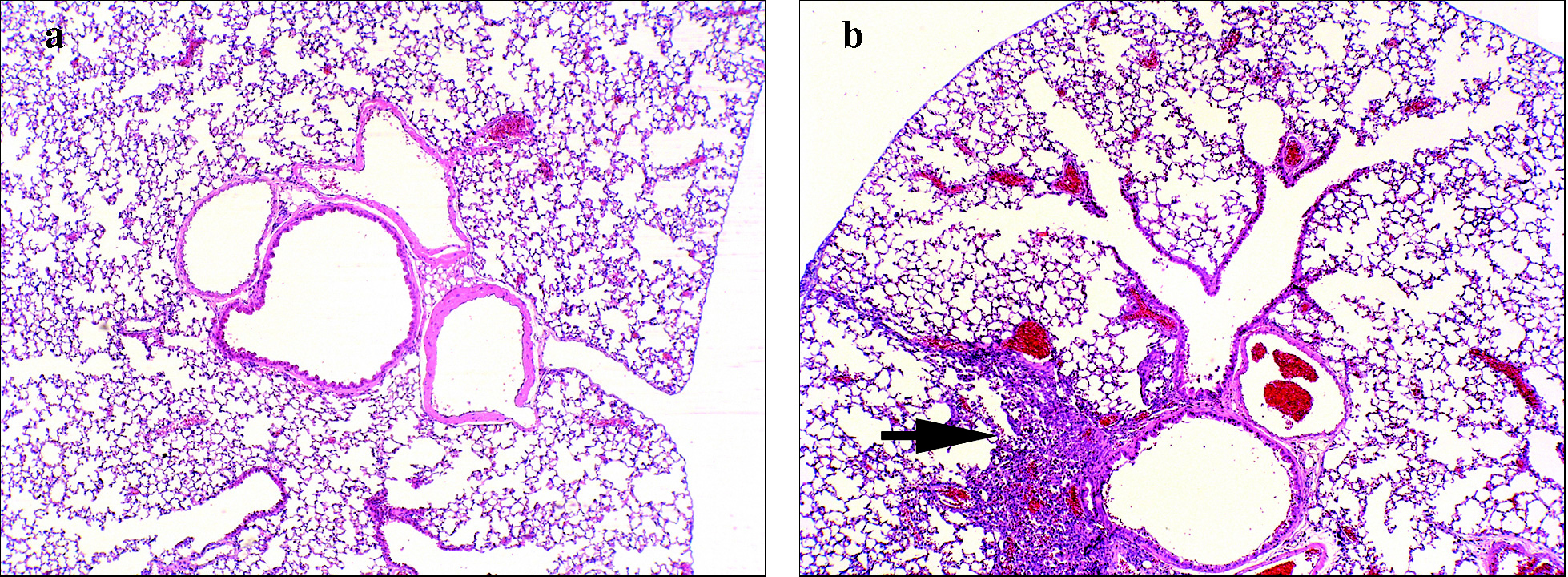
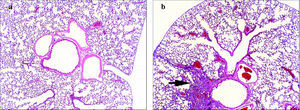
Inflamación broncovascular. En los modelos de asma alérgica inducida en el ratón la inflamación pulmonar se puede evaluar por 2 procedimientos: en el BAL y en secciones histológicas del pulmón13,61,62. Mediante BAL se cuantifican tanto el número total de células presentes en el árbol traqueobronquial extraíbles mediante lavado como los porcentajes de las diversas poblaciones celulares. Normalmente, en el humano y el ratón, la cantidad de células inflamatorias encontradas en el BAL se correlaciona con el tipo y grado de inflamación observada en el parénquima pulmonar mediante estudios anatomopatológicos13,61-63. Si bien con este último procedimiento la cuantificación no es tan fácil como con el BAL, sí permite la localización tisular de los elementos detectados. En las secciones histológicas de pulmón teñidas con hematoxilina y eosina suele observarse una inflamación broncovascular que, como se muestra en la figura 3, se puede distribuir en focos pequeños y densos, aunque también puede abarcar zonas más extensas; estos últimos infiltrados son por lo general más difusos. En todos los procesos inflamatorios en ratones asmáticos hay, en mayor o menor medida, eosinófilos (del 30 al 80% según el modelo) y las vías respiratorias afectadas pueden ser tanto las principales como las más pequeñas. Las variaciones en cuanto a la composición celular, el grado de inflamación y la localización de los focos inflamatorios dependen del protocolo de inmunización y de la cepa de ratón13,61,62,64. En los modelos de inducción más naturales como, por ejemplo, aquellos en los que se expone al ratón al alérgeno sin coadyuvantes como el alum, se tiende a generar un proceso inflamatorio más parecido al observado en las biopsias y autopsias de los bronquios de individuos asmáticos.
Fig. 3. Microfotografía (x100) de una sección histológica de pulmón de: a) ratón control (no asmático), y b) ratón con asma inducida por ovoalbúmina (sensibilización por vía intraperitoneal con ovoalbúmina y sulfato de aluminio o alum; challenge con ovoalbúmina al 1% nebulizada). Las secciones se tiñeron con hematoxilina-eosina. La flecha indica un foco inflamatorio del infiltrado broncovascular típico del modelo de asma en ratón.
La inflamación en los pulmones de pacientes asmáticos se caracteriza sobre todo por la infiltración de la mucosa bronquial por linfocitos T, eosinófilos y la presencia de mastocitos25. Los linfocitos mayoritariamente reclutados son los CD4+ T helper o colaboradores tipo 2 (Th2), un subtipo celular normalmente asociado a procesos patológicos de origen alérgico, que una vez activados atraen y estimulan fundamentalmente a eosinófilos. Se observó inicialmente en modelos de asma en ratón que la "memoria" inmunológica que hace que un animal sensibilizado que vuelve a entrar en contacto con el alérgeno desarrolle asma se debe principalmente a la persistencia de los linfocitos T infiltrados en el parénquima pulmonar62. Los eosinófilos reclutados y activados posiblemente son en parte causantes, junto con los mastocitos y otras células efectoras activadas in situ, como los macrófagos pulmonares y las células epiteliales de la mucosa respiratoria, del daño y de la reestructuración tisular o remodeling mediante la liberación de múltiples mediadores65. A diferencia de las personas, en los modelos de asma en el ratón los eosinófilos no se localizan en el epitelio de la mucosa bronquial, ni se observa que éstos se hayan desgranulado tras el contacto con el alérgeno66. De entre los mediadores eosinofílicos se destacan proteínas y radicales de oxí ;geno altamente reactivos y con capacidad para provocar daño67. Por eso, sorprende en principio que se haya conseguido inducir modelos de asma alérgica en ratón en ausencia de eosinofilia en las vías respiratorias37, aunque se empieza a proponer que quizá los eosinófilos ejerzan una función reguladora más que efectora o proinflamatoria en el asma crónica, como, por ejemplo, la de ayudar a mantener la respuesta Th268-70.
Los mastocitos se consideran principalmente células efectoras en la patogenia de la fase temprana del asma71. Se ha visto que en las vías respiratorias de pacientes asmáticos hay muchos mastocitos y mediadores mastocitarios liberados tras la activación72. Incluso se ha correlacionado la concentración de estos mediadores con un aumento de la obstrucción pulmonar73 y con la hiperreactividad bronquial de pacientes con asma74,75. Hay muchas evidencias que apuntan a que los mastocitos también participan en la fase tardía del asma crónica. Por un lado, citocinas que se sabe son de origen mastocitario como la interleucina (IL) 4 y la IL-13 podrían promover o contribuir a la respuesta inmunitaria de tipo Th2 característica del asma. Por otro lado, los mastocitos participan en el reclutamiento de células inflamatorias, especialmente de linfocitos Th2 y de eosinófilos a través de la prostaglandina D276, un mediador asociado a modelos experimentales de asma en el ratón77. Además, en protocolos de inducción de asma en los que se prescinde de inmunización sistémica y, por lo tanto, en los que supuestamente las células Th2 no participan, para observar eosinofilia pulmonar se requiere de la presencia y activación de mastocitos56,78. Esto refleja la probable importancia de los mastocitos en el establecimiento de la inflamación alérgica en modelos de asma, además de su participación en fases más tempranas. A diferencia de lo observado en individuos asmáticos, no se ha logrado todavía ningún modelo de asma crónica en ratón en el que se detecte la presencia de mastocitos infiltrados en la mucosa respiratoria79.
Reestructuración tisular o remodeling. Una de las características más importantes del asma crónica en los pacientes es la reestructuración tisular, que se produce como consecuencia de un proceso anómalo de reparación de los tejidos que sigue a la inflamación crónica. Las observaciones histológicas propias de la reestructuración son hipertrofia/hiperplasia epiteliales, fibrosis subepitelial, hiperplasia de las células caliciformes productoras de moco (y, como consecuencia, hipersecreción mucosa) e hiperplasia de la musculatura lisa bronquial80. Estos cambios estructurales conducen a un engrosamiento de la pared de la mucosa respiratoria y, en consecuencia, a un estrechamiento de las vías respiratorias, que se manifiesta por una disminución crónica de la función pulmonar que agrava la hiperreactividad bronquial81. Se ha podido inducir remodeling a ratones transgénicos no asmáticos que sobreexpresan citocinas de tipo Th282-84, lo que apunta a la relevancia de estas citocinas en el proceso. El remodeling, sin embargo, no se pudo reproducir en modelos de asma alérgica en el ratón hasta que se establecieron los modelos crónicos. Los modelos crónicos actuales permitirán por lo tanto explicar en parte cómo se produce el fenómeno y de qué manera contribuye éste a la obstrucción bronquial. Hasta hoy estos modelos muestran muchas de las características histológicas del remodeling descritas anteriormente13,42,85, aunque ninguno de ellos las reproduce en su totalidad. Cabe destacar que uno de los modelos que imita más fielmente el proceso es, como ya se ha dicho, el descrito por Johnson et al13, en el que se utiliza un aeroalérgeno natural como el ácaro del polvo. En él se prescinde de la inmunización sistémica y de los coadyuvantes, se utiliza un alérgeno causante de asma en pacientes (aeroalérgeno) y la vía de sensibilización respiratoria es la misma que la que muy probablemente se utiliza de forma natural. Cabe también destacar que en el modelo de Johnson et al13 se trata, al igual que en la enfermedad espontánea, de exponer al ratón a un contacto continuo con el alérgeno, no a un contacto alternante o en ciclos. Este último punto reviste un particular interés porque se puede estudiar la evolución de los síntomas y de la patogenia del asma evaluando el modelo a distintos tiempos, desde pocos días hasta las 7 u 8 semanas desde el inicio de la sensibilización. En los nuevos modelos crónicos se puede determinar, además del remodeling, la evolución de procesos como la inflamación pulmonar y la hiperreactividad bronquial.
Mediadores en el asma experimental
Citocinas. Numerosos grupos han investigado la importancia de las citocinas en los diversos modelos de asma en el ratón. Se ha estudiado la expresión local y sistémica de citocinas y se ha inducido asma a ratones genéticamente deficientes en alguna de ellas para establecer su relevancia. Además de su expresión local, también se ha determinado la expresión sérica de muchas de esas citocinas. Estos mediadores inmunitarios desempeñan un papel inmunorregulador de la respuesta alérgica, y algunas de ellas cumplen una función inductora del proceso inflamatorio broncovascular. El patrón de expresión de las citocinas ha llevado a pensar que en la mayoría de los modelos de asma alérgica en múrido s, al igual que en el humano, predomina una respuesta de tipo Th213,62,86; es decir, que los linfocitos CD4+ Th2 que reconocen al alérgeno se activan y se diferencian en un subtipo celular que se caracteriza por liberar un determinado abanico de citocinas, de entre las cuales destacan la IL-4, la IL-5 y la IL-13. La consecuencia de la polarización hacia este tipo de respuesta inmunitaria es que se activa un clon específico de linfocito B productor y liberador de IgE, y además se reclutan y activan fundamentalmente eosinófilos. En el ratón se ha descrito la relevancia de la IL-587-89 y de la IL-1389-92 en el asma, y se apunta que ambos mediadores y otras citocinas Th2 como la IL-4 modulan en diversas direcciones, al menos en parte, la hiperreactividad bronquial, el infiltrado inflamatorio eosinofílico o la reestructuración pulmonar (remodeling)82-84,92-94.
Eicosanoides. Los productos del metabolismo del ácido araquidónico, o eicosanoides, se han asociado desde la década de 1970 al asma. Estas moléculas hoy se consideran relevantes, tanto las de la vía de la ciclooxigenasa (COX), esto es, las prostaglandinas (Pg), como las de la vía de la lipooxigenasa (leucotrienos).
Por ejemplo, la inhalación de PgE2 se sabe que atenúa la respuesta asmática inducida en pacientes por los aeroalérgenos. Además, de acuerdo con ello, algunos investigadores han demostrado que células de las vías respiratorias tienen una menor capacidad de producción de PgE295-97, posiblemente debido a una anomalía en la expresión de la COX tal como se ha descrito en pacientes con asma no alérgica98, una molécula que paradójicamente se conoce sobre todo por su marcado efecto proinflamatorio. Algunos de los datos que revelan la actividad de la COX-2 y la producción de PgE2 en el asma también se han obtenido de estudios en modelos de asma en múridos. Por ejemplo, ratones asmáticos deficientes en COX (knockouts) presentan una inflamación de las vías respiratorias más intensa y una mayor hiperreactividad bronquial al contacto con el alérgeno que los de genotipo salvaje (normales), y estas alteraciones se acompañan de una disminución de la producción de PgE299. De la misma manera, Peebles et al89,100, utilizando inhibidores selectivos y no selectivo de la COX en un modelo de asma en el ratón, describieron que el tratamiento favorecía la respuesta asmática y que ésta se acompañaba también de una disminución de la PgE2 y de un aumento de los leucotrienos. Esta visión del efecto perjudicial de la inhibición de la COX sobre el proceso inflamatorio y la función pulmonar en el asma se ve apoyada por recientes propuestas de que la enzima podría desempeñar funciones antagónicas, pro y antiinflamatorias, dependiendo de la fase de la enfermedad101. De acuerdo con estos resultados hemos obtenido datos preliminares (no publicados) en un modelo de asma inducida por OVA102 en ratones tratados con rofecoxib, un inhibidor selectivo de la COX-2, que indicarían que el bloqueo farmacológico de la enzima redunda en un proceso inflamatorio más intenso y una mayor hiperrespuesta bronquial que en los ratones asmáticos no tratados. Además de la PgE2, como ya se ha dicho, otras moléculas como la PgD2 se asocian al proceso asmático en el ratón77.
Si bien se sabe del incremento de los leucotrienos en el asma humana103 y de la utilidad de los antagonistas de estos mediadores en la mejora del asma104, se ha estudiado poco su relevancia en el proceso asmático inducido en los ratones. Al igual que en el humano, algunos datos apuntan a un incremento de su producción en ratones asmáticos89,99 y otros indican además la participación de los leucotrienos en la reestructuración de las vías respiratorias105. Conviene sin embargo establecer mejor la dinámica de estos mediadores en la hiperreactividad bronquial y en el proceso inflamatorio en los diversos modelos de asma en el ratón.
Inmunoglobulinas en el asma alérgica en el ratón
El primer contacto de un individuo atópico con el alérgeno lo sensibiliza o, en términos inmunológicos, induce la producción de anticuerpos anafilácticos específicos frente a ese alérgeno. El principal anticuerpo anafiláctico es la IgE, una molécula cuyo aumento se observa en prácticamente todos los individuos con asma106. El predominio ya comentado de células Th2 en los individuos asmáticos es probablemente determinante en este fenómeno, porque las citocinas IL-4 e IL-13 propias de la respuesta Th2 contribuyen a la producción prioritaria de IgE frente a otras clases de anticuerpos. El significado clínico o la relación causa-efecto del aumento de IgE en la hiperreactvidad bronquial, en el proceso inflamatorio o en la reestructuración de las vías respiratorias, sobre todo en procesos crónicos, se desconoce. Se sabe, sin embargo, que la IgE producida se une a los mastocitos del sistema respiratorio (en el parénquima pulmonar y la mucosa de las vías respiratorias) y posiblemente a otras células que expresan receptores para esta inmunoglobulina. Los mastocitos sensibilizados con IgE en su superficie y activados tras un nuevo contacto con el alérgeno pueden contribuir como células efectoras, mediante la liberación de una gran diversidad de mediadores, tanto al broncospasmo como a la inducción del proceso inflamatorio. Es de destacar que algunas células que en individuos normales no tienen receptor de IgE lo expresan en individuos asmáticos (células dendríticas, macrófagos, eosinófilos, etc.)107,108. En la mayoría de los modelos de asma inducida en el ratón también se detecta un aumento en el suero de la IgE total y de la IgE específica para el alérgeno. En algunos de ellos existe además una relación directa entre la IgE sérica y el broncospasmo109. Las pruebas de la importancia del aumento de la IgE en asmáticos han llevado al diseño de un nuevo enfoque terapéutico como es el bloqueo de la IgE mediante anticuerpos para evitar que ésta se una a las células efectoras110. Todo ello apunta al probable protagonismo de este anticuerpo en la patogenia del asma.
Sin embargo, la aparente relevancia de la IgE en la patogenia del asma y su consistente incremento en ratones asmáticos no se reflejan siempre en una clara implicación funcional. Así, algunas publicaciones indican que aun en ausencia de IgE se pueden inducir algunos de los modelos de asma en ratones111-114. Por ejemplo, ratones deficientes en IgE o en IL-4 (citocina inductora de la producción de IgE por parte de linfocitos B especializados) presentan hiperreactividad bronquial y el proceso inflamatorio remite sólo en parte111,115. Incluso animales deficientes en células B (por lo tanto, incapaces de producir anticuerpos)116 o carentes de mastocitos (c-kit negativos)51 desarrollan asma aun en ausencia de un infiltrado inflamatorio eosinofílico. Son resultados sorprendentes que minimizan en principio el papel de la IgE y de los mastocitos en algunos de los modelos experimentales. La interpretación de estos datos en cuanto a su repercusión en el asma alérgica humana es difícil. Sin embargo, es importante reseñar que por lo general estos trabajos en los que se cuestiona la importancia de la IgE se han llevado a cabo en modelos de OVA y, salvo excepciones42, en modelos de exposición corta al alérgeno, y es posible que los modelos crónicos con alérgenos naturales más recientemente descritos arrojen datos distintos.
Además de la IgE se ha descrito la presencia de IgG específica en individuos con asma. El papel atribuible a esta inmunoglobulina es menos claro. En algunos modelos de asma alérgica en el ratón se ha detectado también IgG1 específica13,62, pero igualmente su relevancia se desconoce por el momento.
Limitaciones de los modelos de asma en el ratón
Como se ha remarcado en los párrafos anteriores, no existe un modelo experimental idóneo en el que se puedan estudiar todos y cada uno de los fenómenos patogénicos del asma117,118. La elección del modelo adecuado depende de la hipótesis de trabajo. Los modelos de asma en el ratón ofrecen un amplio abanico de posibilidades experimentales, pero su idoneidad debe valorarse en función de los objetivos de la experimentación y teniendo en cuenta ciertas limitaciones, muchas de ellas aplicables a modelos de otras enfermedades en múridos.
Uno de los aspectos que diferencian al modelo de asma inducida en el ratón del asma espontánea en pacientes es que por lo general todos los ratones expuestos al alérgeno desarrollan la enfermedad. La falta aparente de un factor genético individual introduce un elemento de incertidumbre sobre la idoneidad de estos animales para estudios de polimorfismos génicos, aunque algunos se hayan llevado a cabo119. Sin embargo, debe señalarse que sí se puede hablar de cepas de ratones más predispuestas que otras por su fenotipo atópico, principalmente en lo que se refiere a la tendencia a producir IgE33.
Por otro lado, quizá ciertas diferencias inmunológicas entre ambas especies expliquen que en la mayoría de los modelos experimentales se requiera de elevadas concentraciones del alérgeno, en contra de lo que ocurre en humanos. El surgimiento de los modelos crónicos en los múridos ha permitido en parte paliar esta limitación. Como ya se ha apuntado, si bien en las personas con asma alérgica se considera que la IgE y los mastocitos son en principio clave en la fase temprana del asma, en algunos de los modelos murinos esto no parece confirmarse. En ellos se observa que la IgE específica aumenta claramente, pero las implicaciones funcionales de dicho aumento no parecen tan claras. Otro aspecto diferencial es la aparente falta de desgranulación o de actividad eosinofílica en la mayoría de los modelos en el ratón66,120,121, aunque algunos trabajos sí la hayan observado48,105. Esto contradice lo visto en individuos asmáticos, en los cuales los eosinófilos reclutados por el sistema respiratorio presentan síntomas de activación122. Sin embargo, debe decirse en beneficio de los modelos experimentales que no se ha demostrado inequívocamente que dicha desgranulación sea necesaria para la inducción de hiperreactividad bronquial en las personas. A estas diferencias de origen genético y/o inmunológico deben añadirse diferencias anatómicas y fisiológicas entre el sistema respiratorio del ratón y el del humano, y por lo tanto no deben descartarse mecanismos funcionales distintos, al menos en parte, en el desarrollo del broncospasmo entre ambas especies. Por ejemplo, los individuos asmáticos presentan hiperreactividad bronquial a la metacolina incluso en períodos asintomáticos, contrariamente a lo que apunta en su reciente revisión Epstein123, que ha observado que dicha hiperreactividad es transitoria durante el período de exposición al alérgeno en los modelos en el ratón.
Es necesario recordar que las limitaciones son inherentes a cualquier modelo experimental, pero deben tomarse en consideraci ón a la hora de valorar la utilidad de la inducción de asma alérgica para sus propósitos y de interpretar los resultados obtenidos con éstos. Por último, es importante subrayar que el esfuerzo por inducir modelos crónicos en gran medida permitirá subsanar estas limitaciones.
Conclusiones: el ratón asmático, un valor añadido
No cabe duda de que el modelo de asma en el ratón ocupa un espacio único en la investigación de los mecanismos del asma alérgica, fundamentalmente por la suma de 4 razones: a) una gran parte de los fenómenos y procesos inmunológicos e histológicos clave en la patogenia del asma humana se reproducen con creciente fidelidad en el ratón; b) existen equipos que permiten medir la alteración respiratoria en el ratón; c) éste permite investigar con mayor detalle y perspectiva aspectos que en pacientes asmáticos serían inabarcables, y d) por último, el ratón ofrece ventajas experimentales con respecto a otras especies en la inducción de modelos de enfermedad, también asumibles en los modelos de asma, como la manipulabilidad génica (transgénicos y knockouts) y la disponibilidad de reactivos específicos de especie.
El ratón es por lo tanto una herramienta complementaria en la investigación del asma y supone claramente un valor añadido en ese ámbito. Así, es recomendable el estudio en paralelo de los mecanismos del asma alérgica desde distintos enfoques experimentales; la combinación de estudios en pacientes humanos y en modelos en el ratón será probablemente una de las más fructíferas, tanto porque el ratón puede anticipar fenómenos a estudiar en pacientes como porque permite profundizar en aspectos observados previamente en individuos asmáticos.
A pesar del valor de todos los modelos de asma en el ratón y la consistencia de muchos de los hallazgos, existe una cierta variabilidad entre ellos, en gran medida atribuible a la dotación genética de las cepas de ratón utilizadas, a las diferencias en los procedimientos de inducción, a las distintas técnicas de valoración de la respuesta y al momento de la evaluación. No es la finalidad de este artículo destacar ninguno de ellos, pero sí dar algunas pautas que nos parecen importantes y que se han argumentado con mayor detalle anteriormente. Son fundamentales la selección de la cepa de ratón, la del alérgeno y su vía de exposición y la duración del protocolo de sensibilización/activación --distinguiendo entre períodos de exposición corta (días/semanas) y larga (meses)--. En cuanto al alérgeno, si bien la inducción por OVA ha sido y sigue siendo de gran utilidad, dada la relevancia de la estructura antigénica en el tipo de respuesta inmunitaria parece preferible decantarse por aeroalérgenos naturales. Si además el contacto del alérgeno se realiza por vía respiratoria, tanto en su fase inicial de sensibilización como en fases posteriores, y de una manera continua (a diario o prácticamente a diario), en vez de en ciclos, se mimetiza mejor la forma de exposición natural a los alérgenos de los pacientes y, por lo tanto, se logra posiblemente un modelo más fiel. Resulta particularmente interesante disponer en el laboratorio de al menos 2 modelos de asma inducibles por vía aerógena mediante un mismo alérgeno natural: un modelo agudo de exposición corta suficiente para investigar mecanismos inflamatorios y funcionales en los primeros días del proceso, y un modelo crónico de exposición larga en el cual se pueda reproducir el remodeling de la pared bronquial y la subsiguiente alteración funcional respiratoria.
La reproducibilidad de características fisiopatológicas básicas del asma alérgica humana en el ratón, como la hiperreactividad bronquial, la inflamación eosinofílica, la hipersecreción de moco y el remodeling, y la posibilidad de llevar a cabo estudios de la función broncopulmonar en esta especie permiten concluir que estos modelos de asma alérgica son idóneos ante muchos de los interrogantes que suscitan la patogenia y el tratamiento de la enfermedad.
Agradecimientos
Agradecemos al Dr. Alberto Marco su asesoramiento científico y su participación en la obtención de algunos de los resultados propios que se describen, y a Pere Losada su imprescindible contribución al desarrollo de los modelos de asma en el ratón en nuestro laboratorio y a la puesta a punto de la medición de la función pulmonar por pletismografía en animal consciente, lo cual nos ha permitido entender mejor la valía de este modelo experimental.